Внимание!
Доброе утро! С 07.11.2022 г.
Все уроки будут выкладываться в группе Вконтакте.
Там же будут выкладываться ссылки на Телемост по расписанию. Присутствие на уроке строго обязательно!
Ссылка: https://vk.com/club216978964
26.10.2022
Доброе утро.
24.10.2022
Тема: Составление уравнений
окислительно-восстановительных реакций с
использованием метода электронного баланса.
Окислительно-восстановительные реакции.
Окислительно-восстановительные реакции – это реакции, протекающие с изменением степеней окисления атомов элементов, входящих в состав молекул реагирующих веществ:
0 0 +2 -2
2Mg + O2 2MgO,
+5 -2 -1 0
2KClO3 2KCl + 3O2.
Напомним, что степень окисления – это условный заряд атома в молекуле, возникающий исходя из предположения, что электроны не смещены, а полностью отданы атому более электроотрицательного элемента.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью – положительные.
Степень окисления – формальное понятие; в ряде случаев значение степени окисления элемента не совпадает с его валентностью.
Для нахождения степени окисления атомов элементов, входящих в состав реагирующих веществ, следует иметь в виду следующие правила:
1. Степень окисления атомов элементов в молекулах простых веществ равна нулю.
Например:
Mg0, Cu0.
2. Степень окисления атомов водорода в соединениях обычно равна +1.
Например: +1 +1
HCl, H2S
Исключения: в гидридах (соединениях водорода с металлами) cтепень окисления атомов водорода равна –1.
Например:
NaH–1.
3. Степень окисления атомов кислорода в соединениях обычно равна –2.
Например:
Н2О–2, СаО–2.
Исключения:
степень окисления кислорода во фториде кислорода (OF2) равна +2.
степень окисления кислорода в пероксидах (Н2О2, Na2O2), содержащих группу –O–O–, равна –1.
4. Степень окисления металлов в соединениях обычно положительная величина.
Например: +2
СuSO4.
5. Степень окисления неметаллов может быть и отрицательной, и положительной.
Например: –1 +1
HCl, HClO.
6. Сумма cтепеней окисления всех атомов в молекуле равна нулю.
Окислительно-восстановительные реакции представляют собой два взаимосвязанных процесса – процесса окисления и процесса восстановления.
Процесс окисления – это процесс отдачи электронов атомом, молекулой или ионом; при этом степень окисления увеличивается, а вещество является восстановителем:
– 2ē 2H+ процесс окисления,
Fe+2 – ē Fe+3 процесс окисления,
2J– – 2ē процесс окисления.
Процесс восстановления – это процесс присоединения электронов, при этом степень окисления уменьшается, а вещество является окислителем:
+ 4ē 2O–2 процесс восстановления,
Mn+7 + 5ē Mn+2 процесс восстановления,
Cu+2 +2ē Cu0 процесс восстановления.
Окислитель – вещество, которое принимает электроны и при этом восстанавливается (степень окисления элемента понижается).
Восстановитель – вещество, которое отдает электроны и при этом окисляется (степень окисления элемента понижается).
Сделать обоснованное заключение о характере поведения вещества в конкретных окислительно-восстановительных реакциях можно на основании значения окислительно-восстановительного потенциала, который рассчитывается по величине стандартного окислительно-восстановительного потенциала. Однако, в ряде случаев, можно, не прибегая к расчетам, а зная общие закономерности, определить, какое вещество будет являться окислителем, а какое - восстановителем, и сделать заключение о характере протекания окислительно - восстановительной реакции.
Типичными восстановителями являются:
некоторые простые вещества:
металлы: например, Na, Mg, Zn, Al, Fe,
неметаллы: например, H2, C, S;
некоторые сложные вещества: например, сероводород (H2S) и сульфиды (Na2S), сульфиты (Na2SO3), оксид углерода (II) (CO), галогеноводороды (HJ, HBr, HCI) и соли галогеноводородных кислот (KI, NaBr), аммиак (NH3);
катионы металлов в низших степенях окисления: например, SnCl2, FeCl2, MnSO4, Cr2(SO4)3;
катод при электролизе.
Типичными окислителями являются:
некоторые простые вещества – неметаллы: например,галогены (F2, CI2, Br2, I2), халькогены (О2, О3, S);
некоторые сложные вещества: например, азотная кислота (HNO3),серная кислота (H2SO4 конц.), прерманганат калия (K2MnO4), бихромат калия (K2Cr2O7), хромат калия (K2CrO4), оксид марганца (IV) (MnO2), оксид свинца (IV) (PbO2), хлорат калия (KCIO3), пероксид водорода (H2O2);
анод при электролизе.
При составлении уравнений окислительно-восстановительных реакций следует иметь в виду, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Существуют два метода составления уравнений окислительно-восстановительных реакций – метод электронного баланса и электронно-ионный метод (метод полуреакций).
При составлении уравнений окислительно-восстановительных реакций методом электронного баланса следует придерживаться определенного порядка действий. Рассмотрим порядок составления уравнений этим методом на примере реакции между перманганатом калия и сульфитом натрия в кислой среде.
- Записываем схему реакции (указываем реагенты и продукты реакции):
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
- Определяем степени окисления у атомов элементов, изменяющих ее величину:
+7 + 4 + 2 + 6
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
3) Составляем схему электронного баланса. Для этого записываем химические знаки элементов, атомы которых изменяют степень окисления, и определяем, сколько электронов отдают или присоединяют соответствующие атомы или ионы.
Указываем процессы окисления и восстановления, окислитель и восстановитель.
Уравниваем количество отданных и принятых электронов и, таким образом, определяем коэффициенты при восстановителе и окислителе (в данном случае они соответственно равны 5 и 2):
5 S+4 – 2 e- → S+6 процесс окисления, восстановитель
2 Mn+7 + 5 e- → Mn+2 процесс восстановления, окислитель.
4) Далее остальные элементы уравниваем обычным путем и заменяем стрелку в схеме на знак равенства в уравнении реакции:
2KMnO4 +5Na2SO3 + 8H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O.
5) Если водород и кислород не меняет своих степеней окисления, то их количество подсчитывают в последнюю очередь и добавляют нужное количество молекул воды в левую или правую часть уравнения.
Окислительно-восстановительные реакции подразделяются на три типа: межмолекулярные, внутримолекулярные и реакции самоокисления – самовосстановления (диспропорционирования).
Реакциями межмолекулярного окисления – восстановления называются окислительно-восстановительные реакции, окислитель и восстановитель в которых представлены молекулами разных веществ.
Например:
0 +3 0 +3
2Al + Fe2O3 = 2Fe + Al2O3,
Al0 – 3e– → Al+3 окисление, восстановитель,
Fe+3 +3e– → Fe0 восстановление, окислитель.
В этой реакции восстановитель (Al) и окислитель (Fe+3) входят в состав различных молекул.
Реакциями внутримолекулярного окисления – восстановления называются реакции, в которых окислитель и восстановитель входят в состав одной молекулы (и представлены либо разными элементами, либо одним элементом, но с разными степенями окисления):
+5 –1 0
2 KClO3 = KCl + 3O2
2 CI+5 + 6e– → CI–1 восстановление, окислитель
3 2O–2 – 4е– → окисление, восстановитель
В этой реакции восстановитель (O–2) и окислитель (CI+5) входят в состав одной молекулы и представлены различными элементами.
В реакции термического разложения нитрита аммония меняют свои степени окисления атомы одного и того же химического элемента – азота, входящие в состав одной молекулы:
-3 +3 0
NH4NO2 = N2 + 2H2O
N–3 – 3e– → N0 восстановление, окислитель
N+3 + 3e– → N0 окисление, восстановитель.
Реакции подобного типа часто называют реакциями контрпропорционирования.
Реакции самоокисления – самовосстановления (диспропорционирования) – это реакции, при протекании которых один и тот же элемент с одной и той же степенью окисления сам и повышает, и понижает свою степень окисления.
Например: 0 -1 +1
Cl2 + H2O = HCI + HCIO
CI0 + 1e– → CI–1 восстановление, окислитель
CI0 – 1e– → CI+1 окисление, восстановитель.
Реакции диспропорционирования возможны, когда в исходном веществе элемент имеет промежуточную степень окисления.
Свойства простых веществ могут прогнозироваться по положению атомов их элементов в периодической системе элементов Д.И. Менделеева. Так, все металлы в окислительно-восстановительных реакциях будут являться восстановителями. Катионы металлов могут быть и окислителями. Неметаллы в виде простых веществ могут быть как окислителями, так и восстановителями (исключая фтор и инертные газы).
Окислительная способность неметаллов усиливается в периоде слева направо, а в группе – снизу вверх.
Восстановительные способности, наоборот, уменьшаются слева направо и снизу вверх как для металлов, так и для неметаллов.
Если окислительно-восстановительная реакция металлов происходит в растворе, то для определения восстановительной способности используют ряд стандартных электродных потенциалов (ряд активности металлов). В этом ряду металлы расположены по мере убывания восстановительной способности их атомов и возрастания окислительной способности их катионов (см. табл. 9 приложения).
Наиболее активные металлы, стоящие в ряду стандартных электродных потенциалов до магния, могут реагировать с водой, вытесняя из нее водород.
Например:
Ca + 2H2O = Ca(OH)2 + H2 ↑
При взаимодействии металлов с растворами солей следует иметь в виду, что каждый более активный металл (не взаимодействующий с водой) способен вытеснять (восстанавливать) стоящий за ним металл из раствора его соли.
Так, атомы железа могут восстановить катионы меди из раствора сульфата меди (CuSO4):
Fe + CuSO4 = Cu + FeSO4
Fe0 – 2e– = Fe+2 окисление, восстановитель
Cu+2 + 2e– = Cu0 восстановление, окислитель.
В этой реакции железо (Fe) расположено в ряду активности до меди (Cu) и является более активным восстановителем.
Реакция, например, серебра с раствором хлорида цинка будет невозможна, так как серебро расположено в ряду стандартных электродных потенциалов правее цинка и является менее активным восстановителем.
Ag + ZnCl2 ≠
Все металлы, которые стоят в ряду активности до водорода, могут вытеснять водород из растворов обычных кислот, то есть восстанавливать его:
Zn + 2HCl = ZnCI2 + H2↑
Zn0 – 2e– = Zn+2 окисление, восстановитель
2H+ + 2e– → восстановление, окислитель.
Металлы, которые стоят в ряду активности после водорода, не будут восстанавливать водород из растворов обычных кислот.
Cu + HCI ≠
Чтобы определить, может ли быть окислителем или восстановителем сложное вещество, необходимо найти степень окисления элементов, его составляющих. Элементы, находящиеся в высшей степени окисления, могут ее только понижать, принимая электроны. Следовательно, вещества, молекулы которых содержат атомы элементов в высшей степени окисления, будут только окислителями.
Например, HNO3, KMnO4, H2SO4 в окислительно-восстановитель-ных реакциях будут выполнять функцию только окислителя. Степени окисления азота (N+5), марганца (Mn+7) и серы (S+6) в этих соединениях имеют максимальные значения (совпадают с номером группы данного элемента).
Если элементы в соединениях имеет низшую степень окисления, то они могут ее только повышать, отдавая электроны. При этом такие вещества, содержащие элементы в низшей степени окисления, будут выполнять функцию только восстановителя.
Например, аммиак, сероводород и хлороводород (NH3, H2S, НCI) будут только восстановителями, так как степени окисления азота (N–3), серы (S–2) и хлора (Cl–1) являются для этих элементов низшими.
Вещества, в состав которых входят элементы, имеющие промежуточные степени окисления, могут быть как окислителями, так и восстановителями, в зависимости от конкретной реакции. Таким образом, они могут проявлять окислительно-восстановительную двойственность.
К таким веществам относятся, например, пероксид водорода (H2O2), водный раствор оксида серы (IV) (сернистая кислота), сульфиты и др. Подобные вещества, в зависимости от условий среды и наличия более сильных окислителей (восстановителей) могут проявлять в одних случаях окислительные свойства, а в других - восстановительные.
Как известно, многие элементы имеют переменную степень окисления, входя в состав различных соединений. Например, сера в соединениях H2S, H2SO3, H2SО4 и сера S в свободном состоянии имеет соответственно степени окисления –2, +4, +6 и 0. Сера относится к элементам р-электронного семейства, ее валентные электроны расположены на последнем s- и р-подуровнях (...3s3р). У атома серы со степенью окисления – 2 валентные подуровни полностью укомплектованы. Поэтому, атом серы с минимальной степенью окисления (–2) может только отдавать электроны (окисляться) и быть только восстановителем. Атом серы со степенью окисления +6 потерял все свои валентные электроны и в данном состоянии может только принимать электроны (восстанавливаться). Поэтому атом серы с максимальной степенью окисления (+6) может быть только окислителем.
Атомы серы с промежуточными степенями окисления (0, +4) могут и терять и присоединять электроны, то есть быть как восстановителями, так и окислителями.
Аналогичные рассуждения правомочны при рассмотрении окислительно-восстановительных свойств атомов других элементов.
На характер протекания окислительно-восстановительной реакции влияет концентрация веществ, среда раствора и сила окислителя и восстановителя. Так, концентрированная и разбавленная азотная кислота по-разному реагирует с активными и малоактивными металлами. Глубина восстановления азота (N+5) азотной кислоты (окислителя) будет определяться активностью металла (восстановителя) и концентрацией (разбавлением) кислоты.
4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2 + 2H2O,
8HNO3(разб.) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O,
10HNO3(конц.) + 4Мg = 4Mg(NO3)2 + N2O + 5H2O,
10HNO3(c. разб.) + 4Мg = 4Mg(NO3)2 + NH4NO3 + 3H2O.
Существенное влияние на протекание окислительно-восстановительных процессов оказывает реакция среды.
Если в качестве окислителя используют перманганат калия (KMnO4), то в зависимости от реакции среды раствора, Mn+7 будет восстанавливаться по-разному:
в кислой среде (до Mn+2) продуктом восстановления будет соль, например, MnSO4,
в нейтральной среде (до Mn+4) продуктом восстановления будет MnO2 или MnO(OH)2,
в щелочной среде (до Mn+6) продуктом восстановления будет манганат, например, К2MnO4.
Например, при восстановлении раствора перманганата калия сульфитом натрия, в зависимости от реакции среды, будут получаться соответствующие продукты:
кислая среда –
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 +H2O
нейтральная среда –
2KMnO4 + 3Na2SО3 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
щелочная среда –
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + Na2MnO4 + K2MnO4 + H2O.
Температура системы также влияет на ход окислительно-восстановительной реакции. Так, продукты взаимодействия хлора с раствором щелочи будут различны в зависимости от температурных условий.
При взаимодействии хлора с холодным раствором щелочи реакция идет с образованием хлорида и гипохлорита:
0 -1 +1
Cl2 + KOH → KCI + KCIO + H2O
CI0 + 1e– → CI–1 восстановление, окислитель
CI0 – 1e– → CI+1 окисление, восстановитель.
Если взять горячий концентрированный раствор КОН, то в результате взаимодействия с хлором получим хлорид и хлорат:
0 t° -1 +5
3CI2 + 6KOH → 5KCI + KCIO3 + 3H2O
5 │ CI0 + 1e– → CI–1 восстановление, окислитель
1 │ CI0 – 5e– → CI+5 окисление, восстановитель.
Вопросы для самоконтроля по теме
«Окислительно-восстановительные реакции»
1. Какие реакции называются окислительно-восстановитель-ными?
2. Что такое степень окисления атома? Как она определяется?
3. Чему равна степень окисления атомов в простых веществах?
4. Чему равна сумма степеней окисления всех атомов в молекуле?
5. Какой процесс называется процессом окисления?
19.10.2022
Доброе утро.
17.10.2022
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
- перманганат калия (KMnO4);
- дихромат калия (K2Cr2O7);
- азотная кислота (HNO3);
- концентрированная серная кислота (H2SO4);
- пероксид водорода (H2O2);
- оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
- расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2Al0 + Fe+32O3 → Al+32O3 + 2Fe0,
C0 + 4HN+5O3(конц) = C+4O2 ↑ + 4N+4O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
(N-3H4)2Cr+62O7 → N20 ↑+ Cr+32O3 + 4 H2O,
2 NaN+5O-23 → 2 NaN+3O2 + O02↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2S-2 + S+4O2 = 3S + 2H2O
Домашнее задание: Сделать краткий конспект урока.
12.10.2022
Дорогие ребята!
Поздравляем
вас с участием в обучающей открытой ученической олимпиаде по химии. Отвечая на
вопросы и выполняя задания, не спешите, так как ответы не всегда очевидны и
требуют применения не только химических знаний, но и общей эрудиции, логики и
творческого подхода. Желаем вам удачи!
Внимание! Задания выполняем на двойных листиках. Фотографии высылаем до 16-00 на мою почту.
I
уровень (тестовые задания)
Задания
содержат четыре варианта ответов, из
которых лишь один правильный.
1.
Укажите формулу гипса, который является кристаллогидратом: (1 б.)
а)
CaSО₄x2H₂O; в)
Ca(HSO₄)₂;
б) Ca₂(OH)₂SO₄; г)
Ca(OH)₂.
2. Укажите характеристику состава раствора:(1 б.)
а)
массовая доля; в)
объем;
б)
масса;
г) плотность.
3. Укажите смену скорости растворения металла в кислоте со
временем: (1 б.)
а)
увеличивается; в) меняется
неоднозначно;
б) уменьшается; г) не меняется.
4. Укажите признак необратимых реакций: (1 б.)
а)
поглощение тепла; в)
образование осадка;
б)
изменение цвета раствора;
г) выделение тепла.
5. Выберете пару
реагентов, которые взаимодействуют по
окислительно-восстановительному
механизму: (1 б.)
а)
кислота и щёлочь; в)
основной оксид и кислота;
б) нерастворимый гидроксид и кислота; г) металл и кислота.
6. Посчитайте массовую
долю растворенного вещества в 200 г раствора,
образованном при растворении 40 г вещества в воде (5 б.):
а)
0,4; в)
0,1;
б) 0,2; г) 0,3.
7. Определите соотношение масс соли и воды для образования
раствора с массовой долей растворенного вещества 0,1: (5 б.)
а)
10 г соли в 100 г воды; в) 10 г соли в
110 г воды;
б) 10 г соли в 90 г воды; г) 5 г соли в 50 г воды.
8. Выберете пару ионов, которые могут одновременно существовать в водном
растворе: (5 б.)
а) Fe2+ и
Cl¯; в) Fe²+
и PO₄³¯;
б) Fe²+ и S²¯; г) Fe²+ и CO₃²¯.
Всего 20 баллов
II уровень
1. Решите задачу.
При сгорании 2 моль
цинка в кислороде выделяется 696 кДж теплоты. Определите массу образца цинка,
если при его сгорании выделилось 10,44 кДж теплоты. ( 8 б.)
2. Если
нужно уравняйте и классифицируйте такие реакции (6 б.):
а) H₂ + O₂ = H₂O;
б)
Zn + CuCl₂ = ZnCl₂ + Cu;
в) SiO₂ + CIF = SiF₄ + 2Cl₂O;
г) P₂H₄ = P₁₂H₆ + H₂;
д) KMnO₄ + KNO₂ + H₂SO₄ = KNO₃ + MnSO₄ + K₂SO₄ + H₂O;
е) BPI₂ + H₂ = BP + HI.
3. Методом электронного баланса составьте схему
окислительно-восстановительной реакции (8 б.):
KBr + H2SO4 +
K2Cr2O7 → Br2 + Cr2(SO4)3 +
Н2О + K2SO4
4. Решить
задачу (8 б.):
При
упаривании раствора натрий сульфата соль выделяется в виде кристаллогидрата Na2SO4∙10H2O.
Какую массу кристаллогидрата можно получить из раствора массой 228г и массовой
долей натрий сульфата 15%?
Всего 30 балов
III уровень
1. Запишите уравнения реакций, с помощью которых можно осуществить
следующие превращения:
Fe → A → FeCl2+FeCl3 → B+C → A.
Назовите вещества, обозначенные буквами А, В, С.
(15 б.)
2. Как
разделить смесь: а) растительного масла с водой; б)
древесных опилок и мела?(15 б.)
3. В результате взаимодействия щелочного
металла с водой получили раствор щёлочи массой 500г с массовой долей щёлочи 2,8
% и водород объёмом 2,8 л (н.у.).
Укажите порядковый номер этого металла в периодической системе химических
элементов Д.И. Менделеева.( 20
б.)
Всего 50 балов
Итого 100 балов
03.10.2022
Цели: рассмотреть сущность химического равновесия; зависимость положение химического равновесия от различных факторов.
Понятие прямой и обратной реакции
Рассмотрим некоторую абстрактную реакцию, которую запишем в виде:
А + В → АВ, Прямая реакция. Но многие химические реакции могут идти в обратную сторону.
АВ ![]() А + В; Обратная реакция.
А + В; Обратная реакция.
Для краткости такую реакцию записывают, используя две стрелки, одну – вперед, другую – назад.
А + В ![]() АВ
АВ
При повышении температуры скорость большинства химических реакций увеличивается. Но оказывается, что в случае некоторых реакций продукт реакции при температуре, когда она идет с хорошей скоростью, уже начинает разлагаться. В частности, такая ситуация реализуется при взаимодействии водорода с йодом при получении йодоводорода.
Н2 + I2![]() (1)
(1)
Скорость химической реакции увеличивается с увеличением концентрации исходных веществ и соответственно уменьшается с уменьшением концентрации исходных веществ. Получается, что, по мере прохождения реакций, скорость прямой реакции будет уменьшаться, т. к. исходные вещества будут расходоваться. А скорость обратной реакции будет возрастать, потому что концентрация вещества АВ исходного для обратной реакции будет постепенно увеличиваться. До каких пор скорость прямой реакции будет уменьшаться, а обратной увеличиваться? Это будет до того момента, когда скорости прямой и обратной реакции станут равными. Наступит химическое равновесие (рис. 1).

Рис. 1
Химическое равновесие – это состояние реакционной системы, в котором скорости прямой и обратной реакции равны.
Константа равновесия
Равновесная концентрация веществ
Равновесная концентрация веществ – это концентрации веществ в реакционной смеси, находящихся в состоянии химического равновесия. Равновесная концентрация обозначается химической формулой вещества, заключенной в квадратные скобки.
Например, следующая запись ![]() обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.
обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.

Рис. 2
Химическое равновесие (рис. 2) отличается от привычного для нас понятия «равновесие». Химическое равновесие – динамическое. В системе, находящейся в состоянии химического равновесия, происходят и прямая, и обратная реакции, но их скорости равны, и поэтому концентрации участвующих веществ не меняются. Химическое равновесие характеризуется константой равновесия, равной отношению констант скоростей прямой и обратной реакций.
![]()
Константы скорости прямой и обратной реакции – это скорости данной реакции при концентрациях исходных для каждой из них веществ в равных единицах. Также константа равновесия равна отношению равновесных концентраций продуктов прямой реакции в степенях стехиометрических коэффициентов к произведению равновесных концентраций реагентов.
![]()
Если ![]() , то в системе больше исходных веществ. Если
, то в системе больше исходных веществ. Если ![]() , то в системе больше продуктов реакции.
, то в системе больше продуктов реакции.
Обратимые и необратимые химические реакции
Если константа равновесия значительно больше 1, такую реакцию называют необратимой.
Необратимыми называются химические реакции, которые происходят только в одном направлении до полного расходования одного из реагентов.
Например, это реакция:
4Р + 5О2 = 2Р2О5 (2)
Обратимыми называются химические реакции, которые осуществляются во взаимно противоположных направлениях при одних и тех же условиях.
Факторы, влияющие на смещение равновесия
Если изменить внешние условия, то состояние химического равновесия нарушится. Смещение равновесия в зависимости от изменения внешних условий в общем виде определяется
- Принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведённого воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении.
Равновесие смещается вправо, если повысились равновесные концентрации продуктов прямой реакции. Если повышаются равновесные концентрации исходных веществ прямой реакции, то равновесие смещается влево. Какие факторы можно изменять, чтобы сместить равновесие? Это:
- Температура
- Давление
- Концентрации веществ
- Добавление катализатора
- Изменение площади реакционной поверхности гетерогенных реакций
Добавление катализатора и изменение площади реакционной поверхности гетерогенных реакций не оказывают влияние на смещение химического равновесия.

Остальные факторы рассматриваем более детально.
Температура
Реакция синтеза аммиака (рис. 3) относится к экзотермическим реакциям. При прохождении прямой реакции теплота выделяется, а при прохождении обратной – поглощается. Если увеличить температуру, то, согласно правилу Ле Шателье, равновесие сместится в таком направлении, чтобы уменьшить это воздействие. В данном случае влево, так как теплота поглощается. Реакция синтеза аммиака проводится при температуре около 500 ![]()
Если реакция эндотермическая, то повышение температуры приведет к смещению равновесия вправо.
Изменение концентрации веществ
При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится в сторону его расходования, а соответственно, при уменьшении концентрации какого-либо из веществ – в сторону реакции его образования. Например, при увеличении концентрации азота в реакции синтеза аммиака, равновесие сместится вправо, т. е. в сторону расходования азота. Если же в этой реакции удалять из реакционной смеси аммиак, то равновесие сместится в сторону его образования. Сделать это можно, например, при растворении аммиака в воде.
Изменение давления
Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. Если в реакции синтеза аммиака увеличить давление, равновесие сместится в сторону уменьшения числа моль газа. Если слева число моль газа больше, чем справа, равновесие сместится в сторону образования аммиака.
Если число моль газа одинаково и слева и справа, например, в реакции получения оксида азота (II),
N2 +O2![]() (3)
(3)
то изменение давления не будет оказывать влияние на положение химического равновесия в таких реакциях. Изучение химического равновесия имеет большое значение, как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Окончательный выбор условий требует учета влияния их и на скорость процесса.
Ссылка на видео: https://yandex.fr/video/preview/3181820211987476255
Домашнее задание:
Сделать краткий конспект урока.
Задание 1.
Укажите, как надо изменить температуру и давление (увеличить или уменьшить), чтобы равновесие в реакции разложения карбоната кальция: CaCO3 (к) ⇄ CaO (к) + СО2 (г) - 178 кДж сместить в сторону продуктов разложения.
Задание 2.
Рассчитайте равновесную концентрацию йодоводорода, если известно, что Кр = 0,0156, [I2] = [H2] = 0,1 моль/дм3.
28.09.2022
Тема: Скорость химической реакции.
Скорость химической реакции - основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
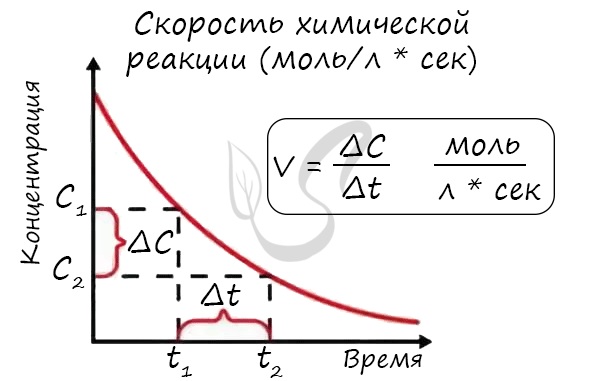
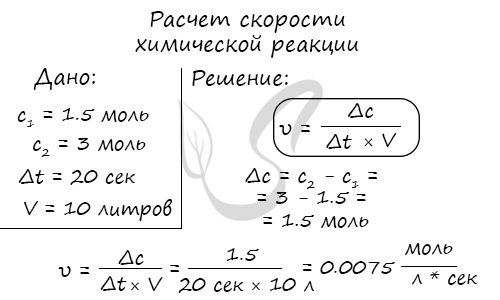
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции - 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо - железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос "какой из металлов Fe или Ca быстрее прореагирует с серой?" мы отдадим предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.

Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос "какой из металлов Li или K быстрее прореагирует с водой?" мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации "прямо пропорционально" скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении - понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости - k - в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени - a и b.
Записанное выше следствие закона действующих масс нужно не только "зазубрить", но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: "Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!"
Очень часто в заданиях следующей темы - химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь и помните про постулат!
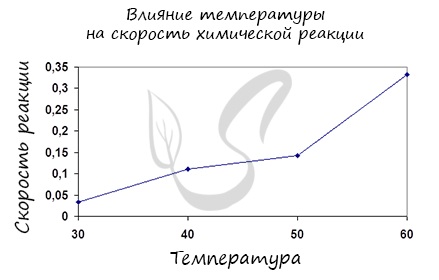
Итак, влияние температуры на скорость реакции "прямо пропорционально": чем выше температура, тем выше скорость реакции - чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая "пропорция".
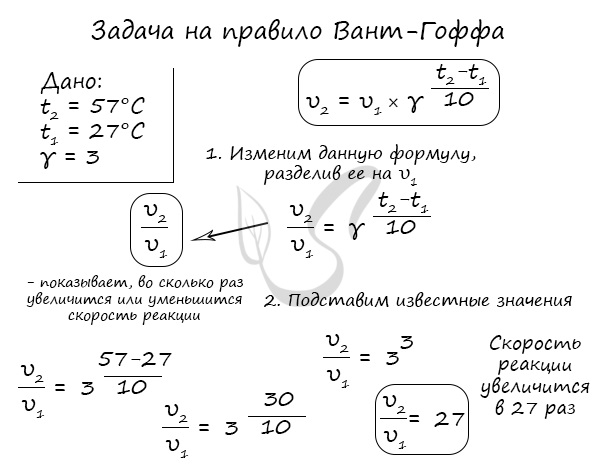
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: "При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза"

В формуле, написанной выше, используются следующие обозначение:
- υ1 - скорость реакции при температуре t1
- υ2 - скорость реакции при температуре t2
- γ - температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: "Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз".

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) - вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов - белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора - каталитическими.

Ингибитор (лат. inhibere - задерживать) - вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
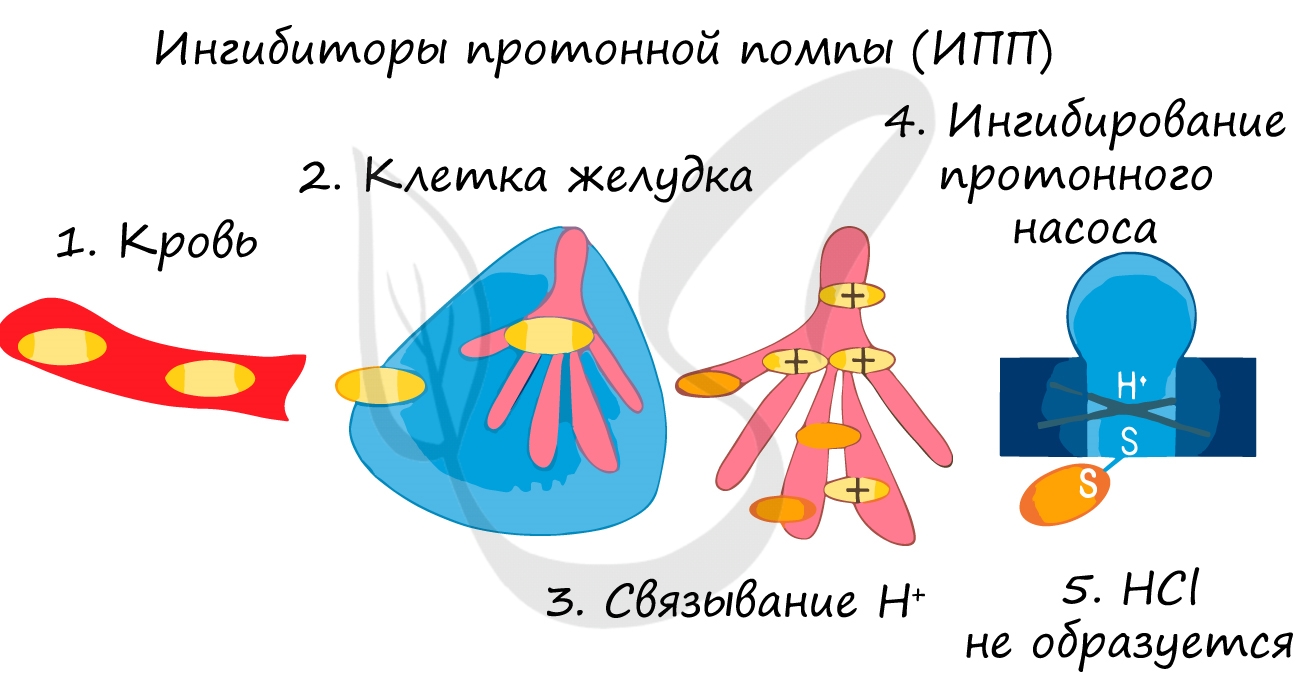
Так при лечении гастрита - воспаления желудка (греч. gaster - желудок) или язв часто назначаются ингибиторы протонной помпы - химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
Домашнее задание:
Выполните тестовое задание:
- Решите задачи:
- 1. В начальный момент времени концентрация исходного вещества Х была равна 2 моль/л. Определите концентрацию вещества Х через одну минуту, если скорость реакции равна 0,01 моль/л·с
- 2. Во сколько раз увеличится скорость реакции при повышении температуры от 150 до 2000С, если при повышении температуры на 100С скорость реакции увеличивается в три раза (γ=3).
21.09.2022
Раньше мы лишь коротко упоминали о реакциях, идущих с выделением или поглощением тепла (см. §5.3). Теперь рассмотрим это явление более подробно, уже на количественном уровне.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Энергия химических соединений сосредоточена главным образом в химических связях. Чтобы разрушить связь между двумя атомами, требуется ЗАТРАТИТЬ ЭНЕРГИЮ. Когда химическая связь образуется, энергия ВЫДЕЛЯЕТСЯ.
Вспомним, что атомы не соединялись бы между собой, если бы это не вело к "выигрышу" (то есть высвобождению) энергии. Этот выигрыш может быть большим или малым, но он обязательно есть при образовании молекул из атомов.
 Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения "старых" связей в исходных веществах, то избыток энергии высвобождается в виде тепла. Примером могут служить реакции горения. Например, природный газ (метан CH4) сгорает в кислороде воздуха с выделением большого количества теплоты (рис. 9-1а). Реакция даже может идти со взрывом - так много энергии заключено в этом превращении. Такие реакции называются ЭКЗОТЕРМИЧЕСКИМИ от латинского "экзо" - наружу (имея в виду выделяющуюся энергию).
В других случаях на разрушение связей в исходных веществах требуется энергии больше, чем может выделиться при образовании новых связей. Такие реакции происходят только при подводе энергии извне и называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании (рис. 9-1б).
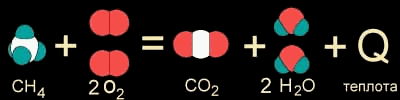
Рис. 9-1а. Уравнение реакции горения метана.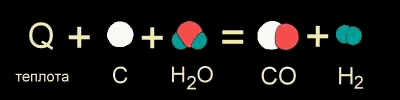
Рис. 9-1б. Уравнение реакции между углем и водой при высокой температуре.
Рис. 9-1а,б. Изображение химических реакций при помощи моделей молекул: а) экзотермическая реакция, б) эндотермическая реакция. Модели наглядно показывают, как при неизменном числе атомов между ними разрушаются старые и возникают новые химические связи.
Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Такая величина называется ТЕПЛОВЫМ ЭФФЕКТОМ РЕАКЦИИ. Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений:
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
или
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж
Оба уравнения одинаково правильны и оба выражают тепловой эффект экзотермической реакции образования воды из водорода и кислорода. Первое - на 1 моль использованного кислорода, а второе - на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды.
Значки (г), (ж) обозначают газообразное и жидкое состояние веществ. Встречаются также обозначения (тв) или (к) - твердое, кристаллическое вещество, (водн) - растворенное в воде вещество и т.д.
Обозначение агрегатного состояния вещества имеет важное значение. Например, в реакции сгорания водорода первоначально образуется вода в виде пара (газообразное состояние), при конденсации которого может выделиться еще некоторое количество энергии. Следовательно, для образования воды в виде жидкости измеренный тепловой эффект реакции будет несколько больше, чем для образования только пара, поскольку при конденсации пара выделится еще порция теплоты.
Используется также частный случай теплового эффекта реакции - ТЕПЛОТА СГОРАНИЯ. Из самого названия видно, что теплота сгорания служит для характеристики вещества, применяемого в качестве топлива. Теплоту сгорания относят к 1 молю вещества, являющегося топливом (восстановителем в реакции окисления), например:
C2H2 | + | 2,5 O2 | = | 2 CO2 | + | H2O | + | 1300 кДж |
ацетилен | теплота сгорания ацетилена |
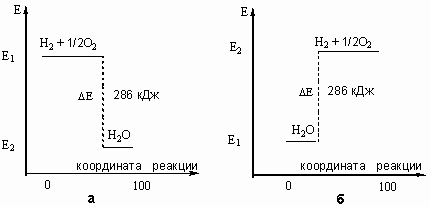
Рис. 9-2. Графическое изображение теплового эффекта (Q = ΔЕ): а) экзотермической реакции горения водорода; б) эндотермической реакции разложения воды под действием электрического тока. Координату реакции (горизонтальную ось графика) можно рассматривать, например, как степень превращения веществ (100% - полное превращение исходных веществ).
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы (рис.9-3).

Рис. 9-3. Самая мощная в мире российская ракета "Энергия" перед стартом на космодроме Байконур. Двигатели одной из её ступеней работают на сжиженных газах - водороде и кислороде.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект - это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей - спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы - калории (1 кал = 4,18 Дж). Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке баночки со сгущенным молоком можно прочитать такую надпись: "калорийность 320 ккал/100 г".
Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ.
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
(CuOH)2 CO3 = 2CuO + H 2 O + CO 2 - 47 кДж
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Решим задачи:
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
Дано: m (Mg0) = 120г Найти: Q1 -? | Решение: 1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу. n = m / M n(MqO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции По уравнению 2 моля MqO - 1204 кДж По условию 3 моля MqO - Q1 |
Отсюда
3 моль* 1204кДж | |||
Q1 | = | ----------------------- | = 1803 кДж |
| 2моль |
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии.
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Дано: Q1 = 652,5 кДж Найти: m(C2H2)-? | Решение: 1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты. По уравнению 2 моль C2H2_---------- 2610 кДж По условию х моль ---------- 652,5 кДж Решаем пропорцию
2) Определяем массу ацетилена по формуле m= n * M m = 0,5 моль * 26 г/моль = 13 г. |
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Дано: m(CH4)= 48г Q1 = 2406 кДж Найти: Q -? | Решение: 1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q 2. Определим количество 48 г метана n = m / M n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции По условию 3моля CH4 - 2406 кДж По уравнению 1 моль CH4 - Q Решаем пропорцию
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж |
Задача 4. Какой объем кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
если на разложение бертолетовой соли было затрачено 182 кДж теплоты.
Дано: Q1 = 91 кДж Найти: V (O2)-? | Решение: 1)Установим пропорциональные отношения между количеством вещества кислорода и количеством теплоты. По уравнению 3 моль O2 ---------- 91 кДж По условию х моль ---------- 182 кДж Решаем пропорцию
2) Вычислим объем кислорода, согласно закону Авогадро (Vm = 22б4 л.моль) V = n * Vm V(O2) = 6 моль * 22,4 л/моль = 134,4 л |
Ответ: объем выделившегося кислорода равен 134,4 л.
Решите самостоятельно:
1. Согласно термохимическому уравнению реакции
CH4+ 2O2 = CO2 +2H2O + 802 кДж
определите количество теплоты, выделившейся при сжигании 24 г метана.
2. Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
3. По термохимическому уравнению H2+ Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
19.09.2022
Химическая реакция — это превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при этом ядра атомов не меняются, происходит только перераспределение электронов и ядер, и образуются новые химические вещества. При химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов (в отличие от ядерных реакций).
Классификация химических реакций схема
Химические реакции классифицируются по тепловому эффекту, по изменению степени окисления атомов в реагирующих веществах, по числу и составу исходных и образующихся веществ, и по признаку обратимости.

Классификация химических реакций по числу и составу исходных и образующихся веществ
Химическая реакция | Определение | Примеры |
Разложения А → В + С + D | Реакция, в которой из одного исходного вещества образуется несколько новых веществ | 2HgO →t→ 2Hg + O2 CaCO3 → CaO + CO2 4HNO3 → 2H2O + 4NO2 + O2 |
Замещения А + ВС → АВ + С | Реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества | Fe + CuSO4 → FeSO4 + Сu CuSO4 + Fe → FeSO4 + Cu 2KBr + Cl2 → 2KCl + Br2 |
Обмена АВ + CD → АС + BD | Реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества | 2AgNO3 + H2SO4 → Ag2SO4 + 2HNO3 NaOH + HCl → NaCl + H2O CH3COONa + H2O → CH3COOH + NaOH |
Соединения А + В + С → D | Реакция, в результате которой из двух или нескольких веществ образуется одно новое | HCl + NH3 → NH4Cl↓ CaO + H2O → Ca(OH)2 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 |
Классификация химических реакций по тепловому эффекту
Тепловой эффект химической реакции — это количество теплоты (Q), которое выделяется или поглощается в химической реакции.
Реакция | Определение | Пример |
Эндотермическая | Реакция, проходящая с поглощением теплоты | N2 + O2 → 2NO - 90,4 кДж |
Экзотермическая | Реакция, проходящая с выделением теплоты | Н2 + Сl2 → 2НСl + 92,3 кДж |
Термохимическое уравнение — уравнение химической реакции, в котором указан тепловой эффект реакции:
2Н2 + 0 = 2Н2O + 484 кДж
2NH3 → N2 + ЗН2 - 46,36 кДж.
Классификация химических реакций по признаку обратимости
Реакция | Определение | Примеры |
Обратимая | Такая реакция, которая в данных условиях протекает одновременно в двух взаимно противоположных направлениях | ЗН2 + N2 ↔ 2NH3 Вг2 + Н2O ↔ НВrО + НВr |
Необратимая | Такая реакция, которая в данных условиях протекает до конца, т. е. до полного превращения исходных реагирующих веществ в конечные продукты реакции | 2Н2(г) + O2(г) → 2Н2O(ж) СН4 + 2O2 → СO2 + 2Н2O |
Таблица признаки необратимости реакций
Признак | Примеры |
Реакция идет с выделением большого количества теплоты | 2Mg + O2 → 2MgO + Q |
Хотя бы один продукт реакции покидает сферу реакции (выпадает в осадок или выделяется в виде газа) | СаСl2 + Na2SO3 → CaSO3↓ + 2NaCl CaCO3 →t→ CaO + CO2↑ |
В результате реакции образуются малодиссоциируе-мые вещества | (CH3COO)NH4 + H2O → CH3COOH + NH4OH HCl + NaOH → NaCl + H2O |
Классификация химических реакций по изменению степени окисления
Химическая реакция | Определение | Примеры |
Проходящая с изменением степени окисления атомов (окислительно-восстановительная) | реакция, при которой происходит переход электронов от одних атомов, молекул или ионов к другим | H2S-2 + 020 → S0 + Н2O-2 -2KI-1 + Сl20 → 2КСl-1 + I20 |
Проходящая без изменения степени окисления | Реакция, в которой степень окисления каждого атома после реакции остается неизменной | 2АlСl3 + 3Na2S + 6Н2O → 2Аl(ОН)3↓ + 3H2S↑ + 6NaCl H2SO4 + NaOH → NaHSO4 + H2O |
Посмотрите видео по ссылке: https://yandex.fr/video/preview/4173760212847481613
Домашнее задание:
1. Реакция 3CaО + P2O5 = Ca3(PO4)2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
2. Реакция Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
3. Реакция H2SO4 + Fe = FeSO4 + H2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
4. Реакция CaCO3 = CaO + CO2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
5. Реакция разложения описана уравнением
1) Cu(OH)2 = CuO + H2O
2) BaO + H2O = Ba(OH)2
3) Na2SO4 + BaCl2 = ZnCl2 + BaSO4
4) FeO + H2 = Fe + H2O
6. Реакция соединения описана уравнением
1) Br2 + H2 = 2HBr
2) H2SO4+ 2NaOH = Na2SO4 + 2H2O
3) ZnS + 2HCl = ZnCl2 + H2S
4) HI + NaOH = NaI + H2O
7. К реакциям замещения относится взаимодействие
1) серной кислоты и гидроксида натрия
2) серной кислоты и железа
3) серной кислоты и оксида натрия
4) серной кислоты и хлорида бария
8. При нагревании нитрата серебра происходит реакция
1) соединения
2) разложения
3) замещения
4) обмена
12.09
Классификация неорганических веществ (Повторение)
Неорганическая химия - раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO - соответствует основанию Cu(OH)2
- Li2O - соответствует основанию LiOH
- FeO - соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 - соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 - соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι - двойственный)
- Кислотные
- SO2 - H2SO3
- SO3 - H2SO4
- P2O5 - H3PO4
- N2O5 - HNO3
- NO2 - HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 - не реагирует с водой, так как продукт реакции - H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)

Несолеобразующие оксиды - оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания - химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр - NaOH, едкое кали - KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода - реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами - с образованием соли и воды, так и с основаниями - с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода - при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота - химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней - часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 - двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода - реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду - угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде "H2CO3 или H2SO3" - будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде - виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной - серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной - соляной кислоты - получили более слабую - сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной - серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота - H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соли
Соль - ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль - NaCl.
По классификации соли бывают:
- Средние - продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые - продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные - продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные - содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные - содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные - содержат комплексный катион или анион - атом металла, связанный с несколькими лигандами: Na[Cr(OH)4] (тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в избытке - получается кислая соль, если же в избытке дано основание - средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода), то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота - соляная, вытесняет слабую - угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли - среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)
Домашнее задание:
Выполните тестовое задание:
- Решите задачи:
- 1. В начальный момент времени концентрация исходного вещества Х была равна 2 моль/л. Определите концентрацию вещества Х через одну минуту, если скорость реакции равна 0,01 моль/л·с
- 2. Во сколько раз увеличится скорость реакции при повышении температуры от 150 до 2000С, если при повышении температуры на 100С скорость реакции увеличивается в три раза (γ=3).
07.09.2022
Тема: Закономерности в изменении свойств химических
элементов первых трёх периодов. (Повторение).
Первый период периодической системы элементов
Специфика первого периода заключается в том, что он содержит всего 2 элемента: H и He. Место H в системе неоднозначно: водород проявляет свойства, общие со щелочными металлами и с галогенами, его помещают либо в Ia-, либо (предпочтительнее) в VIIa-подгруппу. Гелий — первый представитель VIIa-подгруппы (однако долгое время Не и все инертные газы объединяли в самостоятельную нулевую группу).
Второй период периодической системы элементов
Второй период (Li — Ne) содержит 8 элементов. Он начинается щелочным металлом Li, единственная степень окисления которого равна I. Затем идёт Be — металл, степень окисления II. Металлический характер следующего элемента В выражен слабо (степень окисления III). Идущий за ним C — типичный неметалл, может быть как положительно, так и отрицательно четырёхвалентным. Последующие N, O, F и Ne — неметаллы, причём только у N высшая степень окисления V соответствует номеру группы; кислород лишь в редких случаях проявляет положительную валентность, а для F известна степень окисления VI. Завершает период инертный газ Ne.
Второй период периодической системы химических элементов
IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 | 7 N | 8 | 9 F | 10 Ne |
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Третий период периодической системы элементов
Третий период (Na — Ar) также содержит 8 элементов, характер изменения свойств которых во многом аналогичен наблюдающемуся во втором периоде. Однако Mg, в отличие от Be, более металличен, равно как и Al по сравнению с В, хотя Al присуща амфотерность. Si, Р, S, Cl, Ar — типичные неметаллы, но все они (кроме Ar) проявляют высшие степени окисления, равные номеру группы. Таким образом, в обоих периодах по мере увеличения Z наблюдается ослабление металлического и усиление неметаллического характера элементов.
Менделеев называл элементы второго и третьего периодов (малых, по его терминологии) типическими. Существенно, что они принадлежат к числу наиболее распространённых в природе, а С, N и O являются наряду с H основными элементами органической материи (органогенами). Все элементы первых трёх периодов входят в подгруппы а.
Современная терминология - элементы этих периодов относятся к s-элементам (щелочные и щёлочноземельные металлы), составляющим Ia- и IIa-подгруппы (выделены на цветной таблице красным цветом), и р-элементам (В — Ne, At — Ar), входящим в IIIa — VIIIa-подгруппы (их символы выделены оранжевым цветом). Для элементов малых периодов с возрастанием порядковых номеров сначала наблюдается уменьшение атомных радиусов, а затем, когда число электронов в наружной оболочке атома уже значительно возрастает, их взаимное отталкивание приводит к увеличению атомных радиусов. Очередной максимум достигается в начале следующего периода на щелочном элементе. Примерно такая же закономерность характерна для ионных радиусов.
Третий период периодической системы химических элементов
IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 | 16 S | 17 Cl | 18 Ar |
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Домашнее задание:
Заполните пропуски
1. Периодическая система химических элементов Д.И.Менделеева состоит из ……… периодов и ………групп.
2. Периоды – это …………………………………………………….………………………………………………………………………….
3. Группы – это ……………………………………………………...………………………………………………………………………… .
4. Периоды состоят из …………………………………………… ,а группы – из ………………………………………………………… .
5. Периоды делятся на ……………. и ……………. , а группы – на ……………. и ……………. .
6. В чем отличие малых и больших периодов?
…………………………………………………………………………..………………………………………………………………………… .
7. В чем отличие главных и побочных подгрупп?
…………………………………………………………………………..………………………………………………………………………… .
Заполните таблицу
Поряд- | Символ | Русское название | Произ- | Номер периода | Номер ряда | Группа | Под- |
7 | N | Азот | Эн | 2-й | 2-й | V | Главная |
1 |
|
|
|
|
|
|
|
| Мg |
|
|
|
|
|
|
|
| Кислород |
|
|
|
|
|
|
|
| Силициум |
|
|
|
|
29 |
|
|
|
|
|
|
|
| He |
|
|
|
|
|
|
| С |
|
|
|
|
|
|
16 |
|
|
|
|
|
|
|
|
|
| Эс |
|
|
|
|
|
| Цинк |
|
|
|
|
|
| Hg |
|
|
|
|
|
|
| Ba |
|
|
|
|
|
|
14 |
|
|
|
|
|
|
|
|
| Фосфор |
|
|
|
|
|
|
|
| Хлор |
|
|
|
|
| Cu |
|
|
|
|
|
|
|
| Серебро |
|
|
|
|
|
|
|
| Калий |
|
|
|
|
|
| Кальций |
|
|
|
|
|
|
|
| Феррум |
|
|
|
|
23 |
|
|
|
|
|
|
|
05.09.2022
Для работы нам понадобятся 1 рабочая тетрадь (38 листов), 1 тетрадь для практических работ (12 листов), 1 тетрадь для контрольных работ (12 листов).
Электронный учебник для 9 класса вы найдете по ссылке: https://cdnpdf.com/pdf-13229-himiya-neorganicheskaya-himiya-8-klass-rudzitis-ge-feldman-fg
Электронный задачник: https://xp4stm90bvzr.frontroute.org/s11/1/1/3/7/8/0-11378.pdf
Тема: Периодический закон. Периодическая система
химических элементов Д. И. Менделеева. Строение атомов. (Повторение).
«Периодическая система химических элементов»
Ключевые слова конспекта: Периодическая система химических элементов Д.И. Менделеева, группы и периоды Периодической системы, физический смысл порядкового номера химического элемента.
Периодическая система химических элементов — это таблица, в которой все химические элементы расположены в порядке возрастания атомных номеров. Таблица включает в себя периоды и группы, т.е. горизонтальные строчки и вертикальные столбцы.
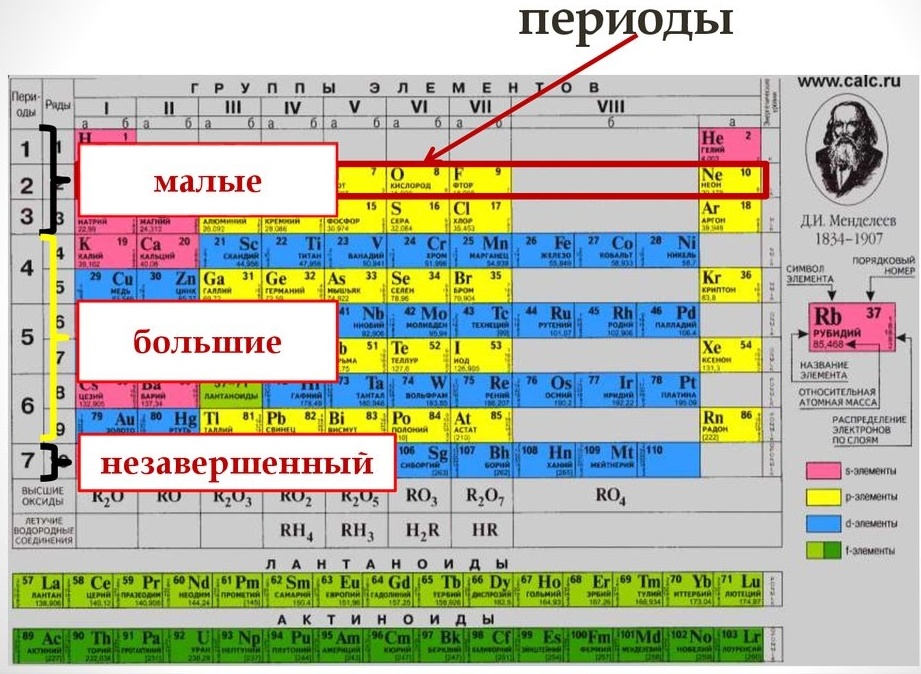
Период — это последовательность (горизонтальный ряд в таблице) элементов с возрастающими атомными номерами, начинающаяся щелочным металлом (или водородом) и заканчивающаяся благородным газом.
Число электронных слоев в атомах данного периода равно номеру периода.
В периодах с возрастанием атомного номера Z металлические свойства ослабевают, а неметаллические усиливаются.
Группа — это вертикальная колонка элементов в таблице, включающая элементы с одинаковой максимальной степенью окисления, равной номеру группы, и одинаковой отрицательной степенью окисления, для атомов неметаллов равной номеру группы минус 8.
В группах с возрастанием атомного номера Z металлические свойства усиливаются, а неметаллические ослабевают. Число валентных электронов атома обычно равно номеру группы.
В коротком варианте таблицы Менделеева различают малые периоды — 1-й, 2-й и 3-й, содержащие 2, 8 и 8 элементов соответственно, а также большие периоды — 4-й, 5-й, 6-й и незавершенный 7-й. Каждый большой период таблицы включает две строчки (два ряда). Например, в 4-м периоде, начинающемся калием 19K, последний элемент в верхней строчке — никель 28Ni, он в числе элементов триады (Fe, Со, Ni) попадает в VIII группу. Следующий элемент — медь 29Cu записан строчкой ниже и находится в I-й группе.
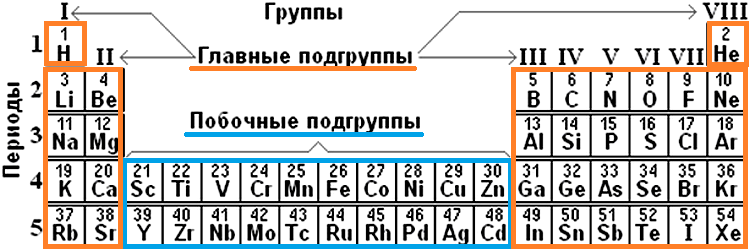
Каждая группа с номерами от I до VIII включает две группы — А и Б.
A-группы включают элементы малых периодов, а также элементы больших периодов, которые по свойствам наиболее близки к соответствующим элементам малых периодов.
Б-группы включают элементы больших периодов, в атомах которых электроны, появляющиеся в них с увеличением заряда ядра, попадают в слой, предшествующий внешнему.
Физический смысл порядкового номера химического элемента:
- это число нейтронов в атоме;
- это относительная атомная масса;
- это число энергетических уровней в атоме;
- это число протонов в ядре.

«Строение атома»
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
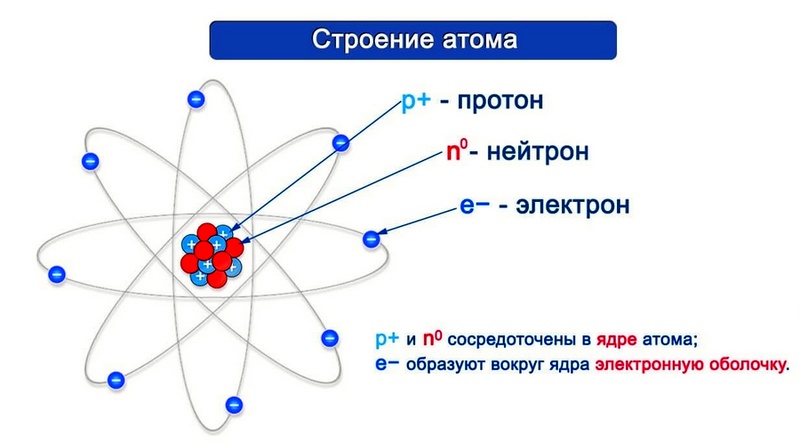
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
Диаметр атома 10-10 м, диаметр ядра 10-14 – 10-15 м. Масса атома водорода равна 1,67 • 10-24 г, атома углерода — 1,99 • 10-23 г, атома железа — 9,29 • 10-23 г.
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
Таблица 1. «Элементарные частицы атома»
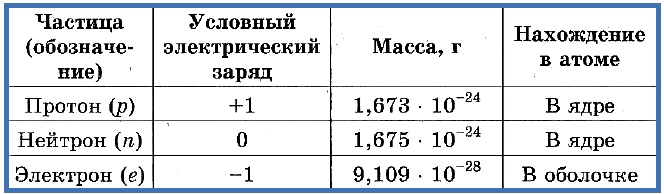
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
Таблица 2. «Протоны и электроны в атомах»
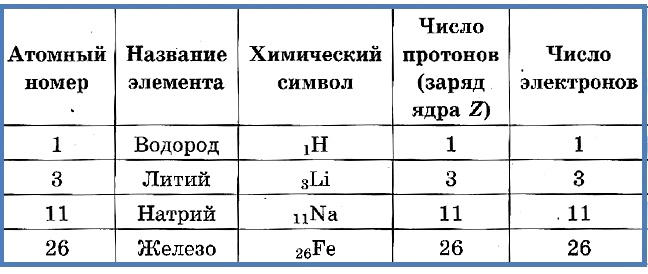
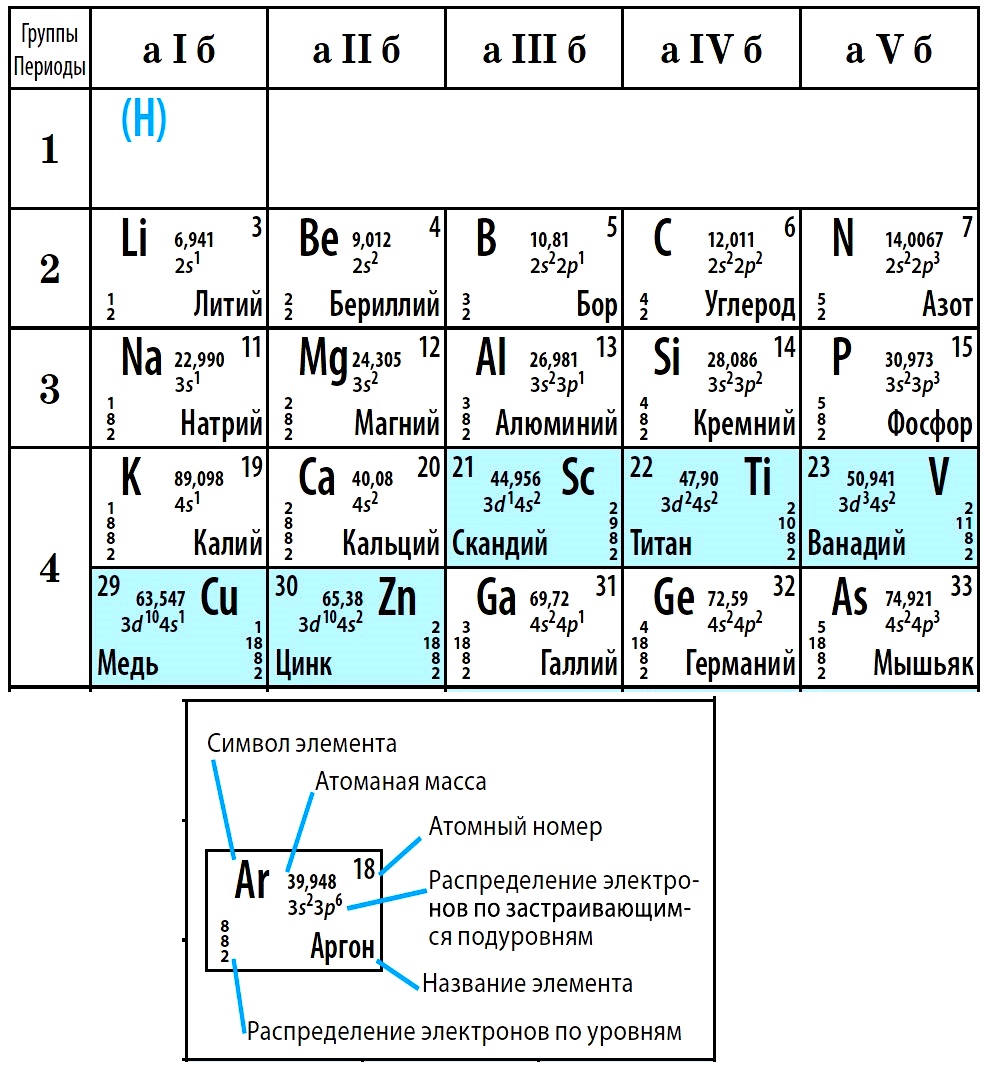
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23Na или натрий-23.
Массовое число кислорода, А(16О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16О, 17О и 18О.
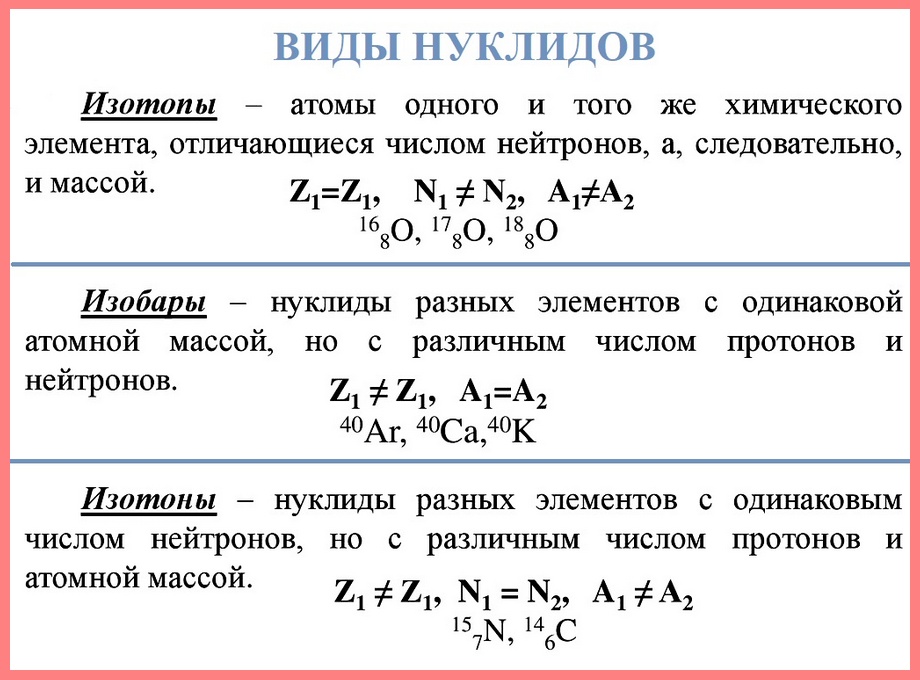
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16О, 17О и 18О — это изотопы. Природные изотопы урана — 234U, 235U и 238U.
Ионы — заряженные частицы, образующиеся при отщеплении от нейтральных атомов или присоединении к ним электронов. Ионы образуются также из молекул в результате присоединения протона Н+ (NH3 → NH4+) или отщепления Н+ (HNO3 -> NO3–).
Таблица 3. «Обозначение и название ионов»

Катионы — это положительно заряженные ионы (Na+, Аl3+), анионы — отрицательно заряженные ионы (Cl–, NO3–).
Заряд иона указывают в виде индекса справа вверху от символа химического элемента: Li+ , Са2+. На первом месте пишут цифру, на втором — знак заряда. Цифру 1 не пишут.
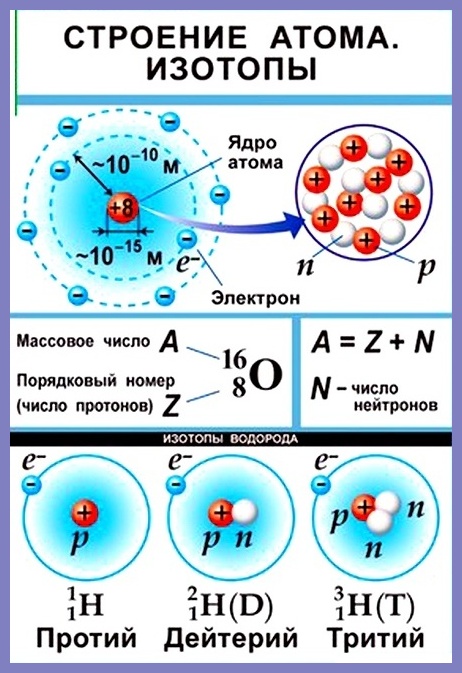
Просмотрите видео по ссылке: https://www.youtube.com/watch?v=vhsSF_7GK2c
Домашнее задание:
Тест по теме: « Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома.»
Вариант 1
1.Какая формулировка Периодического закона является современной ?
а) Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины их атомной массы.
б) Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов их атомных ядер.
2. Изотопы – это :
а) разновидности атомов одного и того же элемента, имеющие разное число электронов
б) атомы, имеющие одинаковое число протонов в ядре, но разное число нейтронов
в) атомы с разным зарядом ядра, но одинаковой массой
г) атомы, имеющие одинаковое число протонов и нейтронов в ядре
3. С увеличением порядкового номера элемента в периоде:
а) радиусы атомов увеличиваются
б) радиусы атомов уменьшаются
в) радиусы атомов не изменяются
4. Радиус какого атома меньше:
а) Li б) Na в) К ?
5.Как определить количество энергетических уровней атома элемента ?
а) по порядковому номеру элемента
б) по номеру группы
в) по номеру периода
6.Чем определяются свойства химических элементов ?
а) величиной относительной атомной массы элемента
б) числом электронов на внешнем энергетическом уровне атома
в) зарядом ядра атома
г) количеством валентных электронов
7. Как изменяются свойства химических элементов в главных подгруппах с увеличением заряда ядер их атомов ?
а) усиливаются металлические свойства
б) ослабевают металлические свойства
в) усиливаются неметаллические свойства
г) ослабевают неметаллические свойства
8. Определите элемент, проявляющий наиболее ярко выраженные металлические свойства
а) Mg б) Al в) Na г) С
9. Что называется электронным облаком ?
а) определённый энергетический уровень, на котором находится электрон
б) пространство вокруг ядра атома, в котором наиболее вероятно пребывание электрона
в) любая часть пространства вокруг ядра и совокупность различных положений электрона
10. Какое число валентных электронов у атома кальция ?
а) 1 б) 2 в) 8 г) 10
Внимание!
Задания высылать на почту: shoshin981@gmail.com
Указывать дату урока. Фамилию Имя, класс, название предмета (Химия).
Удачи!




Комментариев нет:
Отправить комментарий