Внимание!
Доброе утро! С 07.11.2022 г.
Все уроки будут выкладываться в группе Вконтакте.
Там же будут выкладываться ссылки на Телемост по расписанию. Присутствие на уроке строго обязательно!
Ссылка: https://vk.com/club216978964
24.10.2022
Тема: Воздух – смесь газов. Состав воздуха.
Цель. Обобщить и систематизировать знания о воздухе как природной смеси газов, полученные на уроках химии, физики, биологии.
Воздух – природная смесь газов
При слове «воздух» большинству из нас невольно приходит на ум, быть может, несколько наивное сопоставление: воздух – это то, чем дышат. Действительно, в этимологическом словаре русского языка указывается, что слово «воздух» заимствовано из церковно-славянского языка: «воздыхать». С точки зрения биологической, воздух, следовательно, является средой для поддержания жизни за счет кислорода. В составе воздуха могло бы и не быть кислорода – жизнь все равно развивалась бы в анаэробных формах. Но полное отсутствие воздуха, по-видимому, исключает, возможность существования каких бы то ни было организмов.
Для физиков воздух – прежде всего земная атмосфера и газовая оболочка, окружающая землю.
А что же представляет сам воздух с точки зрения химии?
Много сил, труда и терпения потребовалось ученым, чтобы раскрыть эту загадку природы, что воздух – не самостоятельное вещество, как считалось еще более 200 лет тому назад, а представляет сложную смесь газов. Впервые высказался о сложном составе воздуха ученый – художник Леонардо да Винчи (XV век).
Около 4 миллиардов лет назад атмосфера Земли состояла в основном из углекислого газа. Постепенно он растворялся в воде, реагировал с горными породами, образуя карбонаты и гидрокарбонаты кальция и магния. С появлением зеленых растений этот процесс стал протекать гораздо быстрее. К моменту появления человека углекислый газ, так необходимый растениям уже стал дефицитом. Его концентрация в воздухе до начала промышленной революции составляла всего 0,029%. В течение 1,5 млд лет содержание кислорода постепенно увеличивалось.
Химический состав воздуха
Впервые установил количественный состав воздуха французский ученый Антуан Лоран Лавуазье. По результатам своего известного 12-дневного опыта он сделал вывод, что весь воздух в целом состоит из кислорода, пригодного для дыхания и горения, и азота, неживого газа, в пропорциях 1/5 и 4/5 объема соответственно. Он нагревал металлическую ртуть в реторте на жаровне в течение 12 суток. Конец реторты был подведён под колокол, поставленный в сосуд с ртутью. В результате уровень ртути в колоколе поднялся примерно на 1/5. На поверхности ртути в реторте образовалось вещество оранжевого цвета – оксид ртути. Оставшийся под колоколом газ был непригоден для дыхания. Ученый предложил «жизненный воздух» переименовать в «кислород», поскольку при сгорании в кислороде большинство веществ превращается в кислоты, а «удушливый воздух» – в «азот», т.к. он не поддерживает жизнь, вредит жизни.
Основным из составляющих воздуха для нас является кислород, его в воздухе 21% по объему. Разбавлен кислород большим количеством азота – 78% от объема воздуха и сравнительно маленьким объёмом благородных инертных газов – их около 1%. Входят в состав воздуха также переменные составляющие – оксид углерода (IV) или углекислый газ и водяной пар, количество которых зависит от различных причин. Эти вещества попадают в атмосферу естественным путем. При извержении вулканов в атмосферу попадают сернистый газ, сероводород и элементарная сера. Пылевые бури способствуют появлению в воздухе пыли. Оксиды азота попадают в атмосферу и при грозовых электрических разрядах, во время которых азот и кислород воздуха реагируют друг с другом, или в результате деятельности почвенных бактерий, способных высвобождать оксиды азота из нитратов; способствуют этому и лесные пожары и горение торфяников. Процессы разрушения органических веществ сопровождаются образованием различных газообразных соединений серы. Вода в составе воздуха определяет его влажность. У остальных веществ роль отрицательная: они загрязняют атмосферу. Например, углекислого газа много в воздухе городов, лишенных зелени, водяного пара – над поверхностью океанов и морей. В воздухе содержится небольшое количество оксида серы (IV) или сернистого газа, аммиака, метана, оксида азота (I) или закиси азота, водорода. Особенно насыщен ими воздух вблизи промышленных предприятий, газо-нефтяных месторождений или вулканов. В верхних слоях атмосферы существует еще один газ – озон. Летает в воздухе и разнообразная пыль, которую мы можем легко заметить, глядя сбоку на тонкий луч света, попадающий из-за шторы в затемненную комнату.
Постоянные составляющие газы воздуха:
· Кислород
· Азот
· Инертные газы
Переменные составляющие газы воздуха:
· Оксид углерода (IV)
· Озон
· Другие
Вывод.
1. Воздух – природная смесь газообразных веществ, в которой каждое вещество имеет и сохраняет свои физические и химические свойства, поэтому воздух можно разделить.
2. Воздух – это бесцветный газообразный раствор, плотность – 1,293г/л, при температур -1900С он переходит в жидкое состояние. Жидкий воздух представляет голубоватую жидкость.
3. Живые организмы тесно связаны с веществами воздуха, которые оказывают определенное воздействие на них. И в то же время живые организмы влияют на него, так как выполняют определенные функции: окислительно-восстановительную – окисляют, например углеводы до углекислого газа и восстанавливают его до углеводов; газовую – поглощают и выделяют газы.
Таким образом, живые организмы создали в прошлом и поддерживают миллионы лет атмосферу нашей планеты.
Загрязнение атмосферы — привнесение в атмосферный воздух новых нехарактерных для него физических, химических и биологических веществ или изменение естественной среднемноголетней концентрации этих веществ в нём.
В процессе фотосинтеза из атмосферы удаляется углекислый газ, а в процессах дыхания и гниения возвращается. Установившееся в ходе эволюции планеты равновесие между этими двумя газами стало нарушаться, особенно во второй половине XX в., когда стало усиливаться влияние человека на природу. Пока природа справляется с нарушениями этого равновесия благодаря воде океана и его водорослям. Но надолго ли хватит сил у природы?
Схема. Загрязнение атмосферы
Основные загрязнители атмосферного воздуха в России
Количество машин непрерывно растет, особенно в крупных городах, соответственно, растет выброс в воздух вредных веществ. «На совести» автомобилей 60% выбросов вредных веществ в городе!
Предприятия теплоэнергетики России выбрасывают в атмосферу до 30% загрязнителей, а еще 30% – вклад промышленности (черная и цветная металлургия, нефтедобыча и нефтепереработка, химическая промышленность и производство строительных материалов). Уровень загрязнения атмосферы естественными источниками является фоновым (31–41%), он мало изменяется с течением времени (59–69%). В настоящее время глобальный характер приобрела проблема антропогенного загрязнения атмосферы. Какие же вещества-загрязнители, опасные для всего живого, попадают в атмосферу? Это кадмий, свинец, ртуть, мышьяк, медь, сажа, меркаптаны, фенол, хлор, серная и азотная кислоты и другие вещества. Некоторые из названных веществ мы будем изучать в дальнейшем, узнаем их физические и химические свойства и поговорим о таящейся в них разрушительной силе для нашего здоровья.
Масштабы экологического загрязнения планеты, России
В каких странах мира воздух наиболее загрязнен выхлопными газами транспорта?
Наибольшая опасность загрязнения атмосферы выхлопными газами угрожает странам с мощным автопарком. Например, в США на автотранспорт приходится примерно 1/2 всех вредных выбросов в атмосферу (до 50 млн т ежегодно). Автопарк Западной Европы ежегодно выбрасывает в воздух до 70 млн т вредных веществ, причем в Германии, например, 30 млн автомобилей дают 70% общего объема вредных выбросов. В России положение усугубляется тем, что автомашины, находящиеся в эксплуатации, соответствуют экологическим нормам только на 14,5%.
Загрязняет атмосферу и воздушный транспорт шлейфами выхлопов от многих тысяч самолетов. Согласно экспертным оценкам, в результате деятельности мирового автопарка (а это около 500 млн двигателей) в атмосферу ежегодно поступает одного только углекислого газа 4,5 млрд т.
Чем же опасны эти загрязнители? Тяжелые металлы – свинец, кадмий, ртуть – оказывают вредное влияние на нервную систему человека, угарный газ – на состав крови; сернистый газ, взаимодействуя с водой дождей и снегов, превращается в кислоту и вызывает кислотные дожди. Каковы же масштабы этих загрязнений? Главные регионы распространения кислотных дождей – США, Западная Европа, Россия. В последнее время к ним следует отнести и промышленные районы Японии, Китая, Бразилии, Индии. С распространением кислотных осадков связано понятие трансграничности – расстояние между районами их образования и районами выпадения может составлять сотни и даже тысячи километров. Например, главный «виновник» кислотных дождей на юге Скандинавии – промышленные районы Великобритании, Бельгии, Нидерландов и Германии. В канадские провинции Онтарио и Квебек кислотные дожди переносятся из соседних районов США. На территорию России эти осадки переносятся из Европы западными ветрами.
Неблагополучная экологическая ситуация сложилась на северо-востоке Китая, в тихоокеанском поясе Японии, в городах Мехико, Сан-Паулу, Буэнос-Айрес. В России в 1993 г. в 231 городе с общим населением 64 млн. человек содержание вредных веществ в воздухе превышало нормы. В 86 городах 40 млн. человек проживают в условиях, когда загрязнения превышают нормы в 10 раз. Среди этих городов Брянск, Череповец, Саратов, Уфа, Челябинск, Омск, Новосибирск, Кемерово, Новокузнецк, Норильск, Ростов. По количеству вредных выбросов первое место в России занимает Уральский регион. Так, в Свердловской области состояние атмосферы не отвечает нормам на 20 территориях, где проживает 60% населения. В г. Карабаше Челябинской области медеплавильный завод ежегодно выбрасывает в атмосферу по 9 т вредных соединений на каждого жителя. Частота заболеваний раком здесь составляет 338 случаев на 10 тыс. жителей.
Тревожная ситуация сложилась также в Поволжье, на юге Западной Сибири, в Центральной России. В Ульяновске больше, чем в среднем по России, люди страдают заболеваниями верхних дыхательных путей. Заболеваемость раком легких с 1970 г. выросла в 20 раз, в городе зарегистрирован один из самых высоких уровней детской смертности в России.
В г. Дзержинске на ограниченной территории сосредоточено большое количество химических предприятий. За последние 8 лет здесь произошло 60 выбросов сильнодействующих ядовитых веществ в атмосферу, приводивших к чрезвычайным ситуациям, в ряде случаев повлекших за собой гибель людей. В Поволжье до 300 тыс. т сажи, золы, копоти, оксидов углерода обрушиваются на жителей городов ежегодно. Москва занимает 15-е место среди городов России по суммарному уровню загрязнения атмосферного воздуха.
Домашнее задание: Выучить § 27.
Выполнить задание № 5 Стр. 91
21.10.2022
Работу выполняем в тетрадях для контрольных работ. Не забываем верно оформлять расчетные задачи (Дано, Найти, Решение, Ответ).
Тема:
Контрольная работа №1.
Тема «Внутренняя энергия. Количество теплоты»
Вопрос 1
Если тело охлаждается, то его внутренняя энергия...
Вопрос 2
Снег на ладони тает за счет
Варианты ответов
- совершения работы
- конвекции
- теплопроводности
- совершения работы и теплопередачи
- излучения
Вопрос 3
Солнце обогревает Землю. Основным видо теплопередачи в этом случае является...
Вопрос 4
Наибольшей теплопроводностью обладают
Варианты ответов
- жидкости
- газы
- твердые тела
- жидкости и газы
Вопрос 5
Удельная теплоемкость льда 2100 Дж/(кг оС). Это означает, что
Варианты ответов
- при нагревании любой массы льда на 1 градус потребуется количество теплоты 2100 Дж
- Любой массе льда при 0 градусов сообщается количество теплоты 2100 Дж
- 1 кг льда при 0 градусов выделяет количество теплоты 2100 Дж
- для нагревания 1 кг льда на 1 градус потребуется количество теплоты 2100 Дж
Вопрос 6
Горячая вода отличается от холодной тем, что
Варианты ответов
- молекулы горячей воды имеют большие размеры
- молекулы холодной воды имеют большие размеры
- молекулы горячей воды движутся быстрее
- молекулы холодной воды движутся быстрее
Вопрос 7
На рисунке представлены графики зависимости температуры от времени трех тел одинаковой массы. Удельная теплоемкость меньше
Варианты ответов
- у первого тела
- у второго тела
- у третьего тела
Вопрос 8
Какое количество теплоты пойдет на нагревание железа массой 200 г от 20 оС до 220 оС? Удельная теплоемкость железа 460 Дж/(кг оС). Ответ запишите в кДж только число без единиц измерения.
Вопрос 9
При сгорании торфа выделилось 70 000 кДж энергии. Какая масса торфа сгорела?. Удельная теплота сгорания торфа 1,4 * 107 Дж/кг. Ответ запишите в кг , указав только числовое значение.
Вопрос 10
На нагревание воды от 30 оС до 90 оС пошло количество теплоты 126 кДж. Удельная теплоемкость воды 4200 Дж/(кг оС). Чему равна масса нагретой воды? Ответ запишите в граммах в виде чила без единиц измерения..
03.10.2022
Тема: Символы химических элементов.
В химии очень важным является понятие «химический элемент» (слово «элемент» по-гречески означает «составная часть»). Чтобы понять его сущность, вспомните, чем различаются смеси и химические соединения.
Например, железо и сера свои свойства в смеси сохраняют. Поэтому можно утверждать, что смесь порошка железа с порошком серы состоит из двух простых веществ — железа и серы. Так как химическое соединение сульфид железа образуется из простых веществ — железа и серы, то хочется утверждать, что сульфид железа тоже состоит из железа и серы. Но познакомившись со свойствами сульфида железа, мы понимаем, что этого утверждать нельзя. Это сложное вещество, образовавшееся в результате химического взаимодействия, обладает совершенно другими свойствами, нежели исходные вещества. Потому что в состав сложных веществ входят не простые вещества, а атомы определённого вида.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — это определённый вид атомов.
Так, например, все атомы кислорода независимо от того, входят ли они в состав молекул кислорода или в состав молекул воды, — это химический элемент кислород. Все атомы водорода, железа, серы — это соответственно химические элементы водород, железо, сера и т. д.
В настоящее время известно 118 различных видов атомов, т. е. 118 химических элементов. Из атомов этого сравнительно небольшого числа элементов образуется огромное многообразие веществ. (Понятие «химический элемент» будет уточнено и расширено в дальнейших конспектах).
Пользуясь понятием «химический элемент», можно уточнить определения простых и сложных веществ: ПРОСТЫМИ называют вещества, которые состоят из атомов одного химического элемента. СЛОЖНЫМИ называют вещества, которые состоят из атомов разных химических элементов.
Следует различать понятия «простое вещество» и «химический элемент», хотя их названия в большинстве случаев совпадают. Поэтому каждый раз, когда мы встречаем слова «кислород», «водород», «железо», «сера» и т. д., нужно понимать, о чём идёт речь — о простом веществе или о химическом элементе. Если, например, говорят: «Растворённым в воде кислородом дышат рыбы», «Железо — это металл, который притягивается магнитом», это значит, что речь идёт о простых веществах — кислороде и железе. Если же говорят, что кислород или железо входит в состав какого-либо вещества, то имеют в виду кислород и железо как химические элементы.
Химические элементы и образуемые ими простые вещества можно разделить на две большие группы: металлы и неметаллы. Примерами металлов служат железо, алюминий, медь, золото, серебро и др. Металлы пластичны, имеют металлический блеск, хорошо проводят электрический ток. Примерами неметаллов служат сера, фосфор, водород, кислород, азот и др. Свойства неметаллов разнообразны.
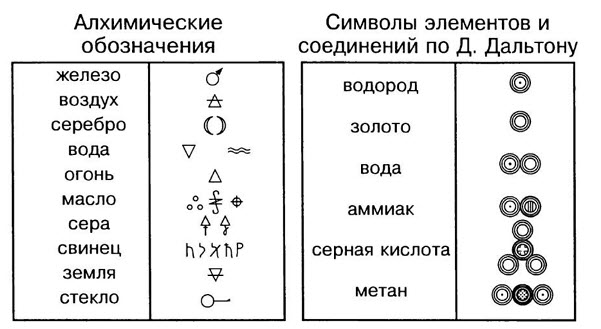
Знаки химических элементов
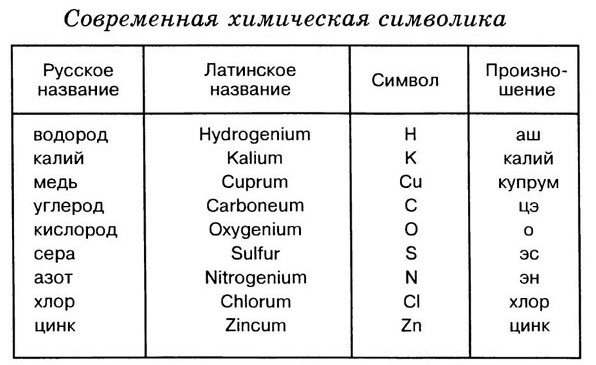
Каждый химический элемент имеет своё название. Для упрощённого обозначения химических элементов используют химическую символику. Химический элемент обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента. Так, водород (лат. hydrogenium — гидрогениум) обозначают буквой Н, ртуть (лат. hydrargyrum — гидраргирум) — буквами Hg и т. д. Предложил современную химическую символику шведский химик Й. Я. Берцелиус в 1814 году
Сокращённые буквенные обозначения химических элементов — это знаки (или символы) химических элементов. Химический символ (химический знак) обозначает один атом данного химического элемента.
Домашнее задание:
Прочитать § 10, 12.
Выучить табл. 2, стр. 43.
Выполнить задания № 1-4, стр.44.
20.09.2022
Практическая работа № 1. Правила работы в лаборатории и
приёмы обращения с лабораторным оборудованием.
Практическая работа № 1. Правила
работы в лаборатории и приёмы обращения с лабораторным оборудованием.
Цель работы: Изучить правила техники безопасности при
работе в химической лаборатории (кабинете), познакомиться с устройством и
основными приёмами обращения с лабораторным оборудованием.
Оборудование: Штатив, спиртовка,
пробирка, стакан с водой, лабораторная посуда.
Ход работы.
I. Правила техники безопасности при работе в
химической лаборатории (кабинете).
1. Категорически запрещается:
брать вещества руками. Твёрдые вещества можно брать из баночек только сухой
специальной ложкой, насыпать твёрдые вещества и наливать жидкости нужно
осторожно и только над столом или специальным поддоном;
пробовать вещества на вкус;
нюхать вещества из горлышка склянок, т.к. вдыхание паров и газов может вызвать
раздражение дыхательных путей. Для ознакомления с запахом нужно ладонью руки
сделать движение от отверстия сосуда к носу;
при смешивании веществ в пробирке зажимать отверстие пальцем;
смешивать вещества без указания учителя.
2. Проводить опыты только с теми веществами, которые указаны учителем.
3. Проводить опыты только с таким количеством веществ, которые указаны в
инструкции.
4. Спиртовку зажигать только спичкой! НЕЛЬЗЯ зажигать спиртовку зажигалкой,
горящей бумагой или другой спиртовкой, т.к. может пролиться спирт и
возникнет пожар! НЕЛЬЗЯ ни в коем случае держать голову близко к пламени
или наклоняться над ним.
5. Тушить пламя спиртовки только колпачком!
6. При нагревании вещества в пробирке её сначала необходимо целиком прогреть
над пламенем; отверстие пробирки направлять в сторону от себя, и от соседей.
7. Соблюдать особую осторожность при работе с едкими веществами –
кислотами и щелочами! ПОМНИТЕ – при разбавлении кислоту медленно
наливают тонкой струйкой в воду!!!
8. В случае ожога, пореза или попадания едкой и горячей жидкости на кожу или
одежду следует немедленно обратиться к учителю или лаборанту!
9. Не загромождать рабочее место посторонними предметами, бережно
обращаться с лабораторным оборудованием!
10. Закончив работу, привести рабочее место в порядок!
II. Лабораторное оборудование.
Ход работы
1. Устройство лабораторного штатива.
Задание: рассмотреть и нарисовать штатив, обозначить его составные части.
2. Устройство спиртовки.
Задание: рассмотреть и нарисовать спиртовку, обозначить её составные
части.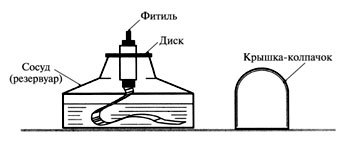
Правила работы со спиртовкой.
1.Снять колпачок
2.Проверить плотно ли прилегает диск к отверстию сосуда
3. Зажечь спиртовку горящей спичкой (НЕЛЬЗЯ ЗАЖИГАТЬ СПИРТОВКУ ОТ ДРУГОЙ ГОРЯЩЕЙ СПИРТОВКИ!)
4. Погасить спиртовку накрыв пламя колпачком.
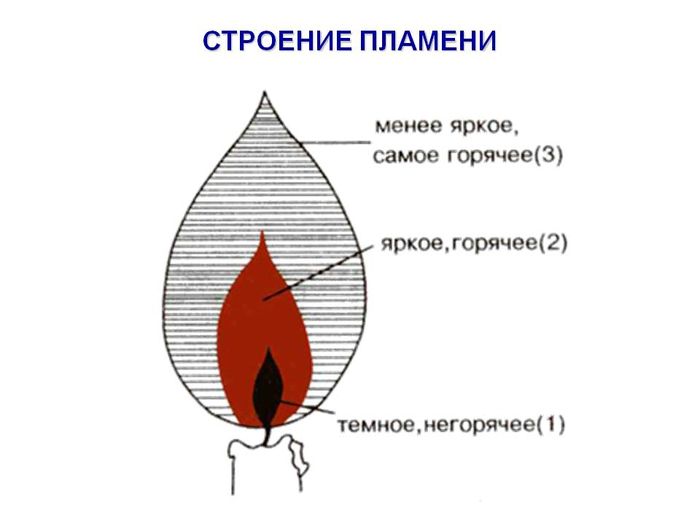
Изучить строение пламени, сделать рисунок.
3. Химическая посуда.
Задание: рассмотреть и нарисовать образцы химической посуды.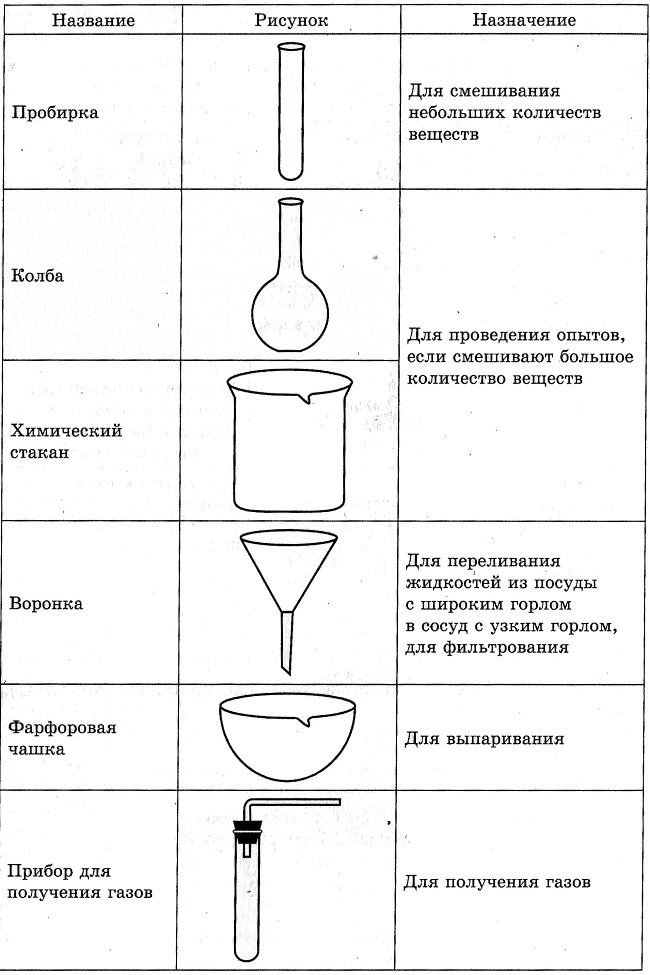
Сделайте выводы о проделанной работе.
12.09.2022
Тема: Чистые вещества и смеси. Способы разделения смесей.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
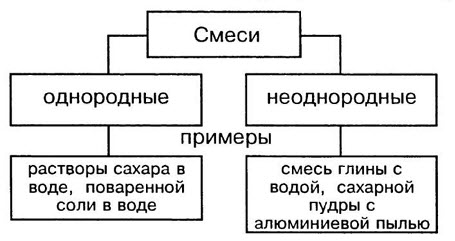
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
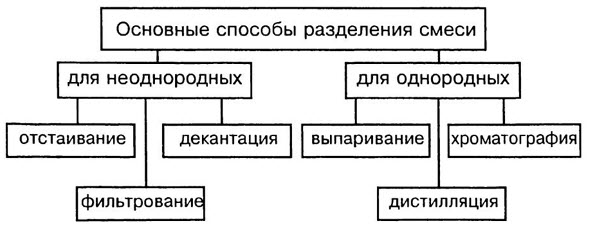
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Домашнее задание:
Сделайте краткий конспект урока.
Выполните следующие задания:
Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) муки от попавших в неё железных опилок;
2) воды от растворённых в ней неорганических солей?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) поваренной соли от попавших в неё железных опилок;
2) воды от мелких частиц карбоната кальция?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
06.09.2022
Тема: Физические свойства веществ. Тела и вещества. Агрегатное состояние веществ.
Все вещества при нормальных условиях могут находиться в трёх cсостояниях: твёрдом, жидком и газообразном. Такие состояния веществ называют агрегатными.
Например, при нормальных условиях вода находится в жидком агрегатном состоянии, при температуре 0 0С вода находится в твёрдом агрегатном состоянии (это всем известный лёд). Ледяной узор на стекле, снег и гигантский айсберг – это всё твёрдое агрегатное состояние воды.

Если воду нагреть до температуры 100 0С, то она переходит в газообразное состояние, так называемый пар. Этот пар представляет собой скопление мельчайших водяных капелек. Облака – это миллиарды мельчайших капелек воды.
Большинство газообразных веществ бесцветны, поэтому увидеть их невозможно. Находясь в сосуде, они принимают его форму. Объём газов зависит от температуры и давления, поэтому газы сжимаемы. Это свойство широко используется. Например, с помощью сжатого воздуха закрываются и открываются двери в автобусе, поток раскалённых газов реактивного двигателя поднимает ввысь самолёты, купол парашюта, наполненный упругим воздухом, позволяет плавно опуститься на землю.
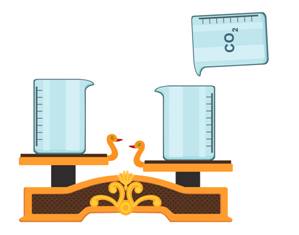
Однако эта «невесомость» газов – понятие относительное. Например, на двух чашах уравновешенных весов стоят одинаковые химические стаканы. Визуально мы не увидим здесь газы. Углекислый газ легко можно «перелить» из сосуда в сосуд. Если взять стакан с углекислым газом и «перелить» его в один из стаканов, то чаша весов опускается вниз. Углекислый газ заполняет стакан и вытесняет воздух из него, поэтому чаша весов опустилась. Из этого можно сделать вывод, что углекислый газ тяжелее воздуха.
Несомненно, переливать жидкости более привычно и наглядно. Если жидкость налить в сосуд, то она примет форму того сосуда, в который её налили. Это отражает такое свойство жидкости, как текучесть. Одни жидкости достаточно быстро растекаются по плоской поверхности, например, вода, спирт, бензин, ацетон. Другие жидкости – очень медленно. Так, капля мёда на стекле будет растекаться очень медленно, для того, чтобы это сделать, нужно стекло поставить вертикально. Жидкости, в отличие от газов, практически не сжимаются. Если хлопнуть по поверхности воды, то эффект будет таким же, как, если хлопнуть по крышке стола.
Если жидкость охладить, то она переходит в твёрдое агрегатное состояние. Твёрдые тела сохраняют свои объём и форму, они практически не сжимаются. Так, кубики льда постоянно буду иметь свои форму и объём, куда бы мы их не перемещали, пока они не растают.
Диффузию, броуновское движение, переход веществ из одного агрегатного состояния в другое относят к физическим явлениям, так как не происходит превращения одних веществ в другие.
Таким образом, физические явления – это явления, при которых изменяются агрегатные состояния веществ, форма и размеры тел, построенных из этого вещества, но сохраняется их химический состав.
В газообразных веществах расстояние между молекулами в десятки раз превышает размер самих молекул, поэтому они слабо связаны друг с другом и газы легко сжимаются. В твёрдых веществах частицы, из которых они состоят, находятся плотно друг к другу и в определённом порядке, как солдаты в строю. Такое упорядоченное строение частиц имеют кристаллы. Силы притяжения частиц в кристаллах велики, оторвать эти частицы очень непросто.
Жидкие вещества – это нечто промежуточное между газами и твёрдыми веществами.
Жидкости имеют объём, как и твёрдые вещества, расстояние между молекулами небольшое, но силы притяжения между частицами не так велики, как в кристаллах.
Есть ещё вещества, которые настолько вязкие, что долго сохраняют свою форму, как твёрдые вещества, однако расположение частиц в них неупорядоченное, как в жидкостях. Такие вещества называются аморфными. Аморфными веществами являются янтарь, воск, стекло, смолы, многие пластмассы.

Но как можно отличить кристаллическое вещество от аморфного? Если, например, нагреть стекло, то оно размягчится, потом становится текучим, пока не превратится в типичную жидкость. То есть резкой границы между аморфными веществами и жидкостями нет.
У каждого же твёрдого вещества есть определённая температура плавления, при которой оно переходит из твёрдого состояния в жидкое.
Домашнее задание:
Сделать краткий конспект урока.
Используя дополнительные источники информации заполните таблицу.
Агрегатное состояние | Цвет | Растворимость в воде | Температура кипения и плавления | Тепло- и электро-проводность | |
поваренная соль | |||||
сахар | |||||
алюминий | |||||
цинк | |||||
железо | |||||
медь | |||||
кислород | |||||
вода | |||||
сера |
05.09.2022
Добрый день! Мы начинаем изучать предмет Химия.
Для работы нам понадобятся 1 рабочая тетрадь (38 листов), 1 тетрадь для практических работ (12 листов), 1 тетрадь для контрольных работ (12 листов).
Электронный учебник для 8 класса вы найдете по ссылке: https://cdnpdf.com/pdf-13229-himiya-neorganicheskaya-himiya-8-klass-rudzitis-ge-feldman-fg
Электронный задачник: https://xp4stm90bvzr.frontroute.org/s11/1/1/3/7/8/0-11378.pdf
Тема: Предмет химии. Роль химии в жизни человека. Химия в системе наук.
Просмотрите видео по ссылке: https://www.youtube.com/watch?v=vhsSF_7GK2c
Мы начинаем знакомство с новым предметом, который называется «химия».
В тетрадях число, классная работа, тема урока.
В младших классах вы изучали природоведение, затем приступили к изучению биологии и физики, познакомились с понятиями «физическое тело» и «вещество».
В: Как вы для себя понимаете, что такое физическое тело?
Ответы учащихся.
Запишем: Физическое тело – это материальный объект, имеющий постоянные массу и форму, и отделенный от других тел.
В: Приведите примеры? (Книга, стол, доска).
Чтобы выяснить, чем отличаются понятия «физическое тело» и «вещество», вспомните из курса природоведения и биологии сведения о составе физических тел, например, гранита и зерна.
Кусок гранита, зерно – это физические тела, но они неоднородны.
На уроках биологии вы изучали, что в состав зерна входят крахмал, белок, растительные жиры; а на уроках природоведения, - что гранит состоит из кварца, слюды и полевого шпата.
Кварц, слюда, полевой шпат, крахмал, белок, жиры – это вещества.
Одни и те же предметы часто изготавливают из разных веществ: например, кружки бывают стеклянные, пластмассовые, металлические (показываю). И наоборот, из одного и того же вещества изготавливают разные предметы: из стекла – посуда, оконное стекло, линзы в приборах (показываю).
Запишем: Свойства вещества – это признаки, по которым вещества отличаются друг от друга или сходны между собой.
Сравним: стекло и металл. Сходны – твердые, различаются – хрупкое/прочное, прозрачное/непрозрачное.
Запишем следующее утверждение: Физические тела состоят из веществ.
Нам необходимо познакомиться с некоторыми свойствами веществ.
Запишем: Важнейшие физические свойства вещества.
1. Агрегатное состояние.
- твердое;
- жидкое;
- газообразное.
2. Цвет, запах.
3. Плотность.
4. Теплопроводность.
5. Электрическая проводимость.
6. Температура плавления и кипения
Итак, мы с вами пришли к выводу – к определению химии, как науки.
Запишем: Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Домашнее задание:
Выучить § 1.
Выполнить письменно задания № 3-5 стр. 6-7.
Внимание!
Задания высылать на почту: shoshin981@gmail.com
Указывать дату урока. Фамилию Имя, класс, название предмета (Химия).
Удачи!
Комментариев нет:
Отправить комментарий