Внимание!
Доброе утро! С 07.11.2022 г.
Все уроки будут выкладываться в группе Вконтакте.
Там же будут выкладываться ссылки на Телемост по расписанию. Присутствие на уроке строго обязательно!
Ссылка: https://vk.com/club216978964
27.10.2022
Доброе утро.
Ссылка на Яндекс Телемост.5-й урок начнется по расписанию.Просьба внимательно следить за расписанием и предупреждать классного руководителя в случае возникновения проблем со связью.
Тема: Причины многообразия веществ.
Цель: опираясь на знания, полученные в предыдущих классах, расширить представления обучающихся о причинах многообразия веществ в природе.
Строение кристаллов и типы кристаллических решеток
Кристаллами называются твёрдые вещества, частицы которых образуют трёхмерную периодическую пространственную структуру, называемую кристаллической решёткой. Грани кристаллов представляют собой правильные многоугольники. Свойства кристаллических тел различны. Например, алмаз обладает максимальной твёрдостью, а графит можно сломать руками, хотя эти вещества состоят атомов углерода. Свойства веществ зависят от типа кристаллической решетки. Различают четыре типа кристаллических решёток: атомную, ионную, молекулярную и металлическую.

Зависимость свойств веществ от типа кристаллической решетки
В узлах атомной кристаллической решётки расположены атомы, соединённые ковалентной связью. Примерами веществ, имеющих атомную кристаллическую решетку, являются алмаз, кремний, германий, бор. Вещества, имеющие атомную кристаллическую решетку, характеризуются высокой температурой плавления, большой твёрдостью.
В узлах ионной кристаллической решётки находятся положительные и отрицательные ионы, связь между ними ионная. Ионную кристаллическую решетку имеют соли, щёлочи и оксиды типичных металлов. Для веществ с ионной кристаллической решеткой характерны высокие температуры плавления, твёрдость, плотность, хорошая электропроводность.
В узлах молекулярной кристаллической решетки находятся молекулы, которые удерживаются за счет межмолекулярных вандервальсовых сил. Примером веществ с молекулярной кристаллической решеткой являются лёд, йод, нафталин, углекислый газ. Межмолекулярные связи значительно слабее ковалентных и ионных, поэтому для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, невысокая твёрдость, возможность возгонки (переход из твёрдого состояния в газообразное, минуя жидкое).
Для металлов характерна металлическая кристаллическая решётка, в узлах которой расположены положительно заряженные ионы металлов, а между ними свободно перемещаются валентные электроны (так называемый электронный газ). Для веществ с металлической кристаллической решеткой характерны механическая прочность, плавкость, ковкость, хорошая тепло- и электропроводность, металлический блеск.
Свойства кристаллических тел определяются не только характером связи между частицами, но и их взаимным расположением относительно друг друга. В кристаллах алмаза все атомы углерода связаны ковалентными неполярными связями и находятся на одинаковом расстоянии друг от друга, образуя тетраэдры. В кристаллах графита каждые шесть атомов углерода связаны ковалентными неполярными связями, а между собой такие плоские шестиугольники связаны слабыми межмолекулярными связями.
Причины многообразия веществ
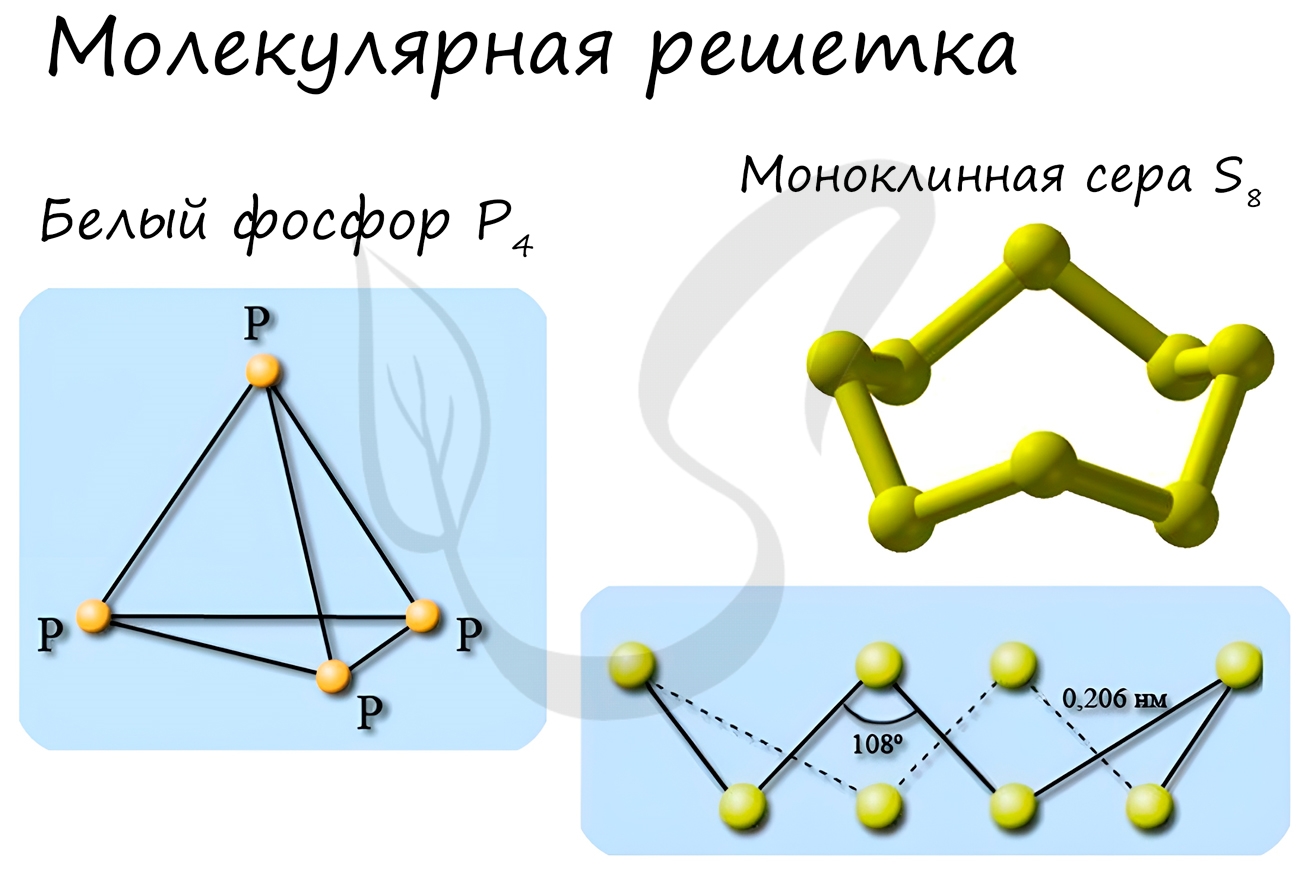
Не только углерод может образовывать разные вещества в зависимости от типа кристаллической решётки. Известно несколько веществ, образованных фосфором (белый, красный, чёрный и металлический фосфор). Сера может существовать в виде трёх модификаций (ромбическая, моноклинная и пластическая). Явление существования нескольких простых веществ, образованных одним и тем же элементом, называется аллотропией (полиморфизмом), а сами простые вещества – аллотропными (полиморфными) модификациями.
Существование изотопов – атомов одного и того же химического элемента, имеющих разные массовые числа - ещё одна причина огромного многообразия веществ.
Изучая органическую химию, вы узнали о существовании изомеров – молекул, имеющих одинаковый состав, но разную последовательность атомов и их расположение в пространстве. Изомеры встречаются не только среди органических соединений, например, изомером карбамида является цианат аммония.
Причиной разнообразия органических соединений является и гомология – существование ряда соединений, имеющих одинаковое строение и химические свойства, но отличающихся друг от друга на целое число групп СН2-.
118 известных на сегодняшний день химических элементов образуют миллионы различных веществ, но человек искусственным путём создает новые вещества с нужными ему свойствами. Создание человеком новых веществ получило название химического синтеза.
Таким образом, явления аллотропии (полиморфизма), изомерии, изотопии, гомологии, химический синтез новых соединений являются причинами многообразия веществ.
Домашнее заданиеИзучить содержание конспекта.
Решить задачу: выведите молекулярную формулу и составьте возможные структурные формулы, если:
ω(С)=0,52
ω(О)=0,35
ω(Н)=0,13
Dн2= 23
Строение кристаллов и типы кристаллических решеток
Кристаллами называются твёрдые вещества, частицы которых образуют трёхмерную периодическую пространственную структуру, называемую кристаллической решёткой. Грани кристаллов представляют собой правильные многоугольники. Свойства кристаллических тел различны. Например, алмаз обладает максимальной твёрдостью, а графит можно сломать руками, хотя эти вещества состоят атомов углерода. Свойства веществ зависят от типа кристаллической решетки. Различают четыре типа кристаллических решёток: атомную, ионную, молекулярную и металлическую.

Зависимость свойств веществ от типа кристаллической решетки
В узлах атомной кристаллической решётки расположены атомы, соединённые ковалентной связью. Примерами веществ, имеющих атомную кристаллическую решетку, являются алмаз, кремний, германий, бор. Вещества, имеющие атомную кристаллическую решетку, характеризуются высокой температурой плавления, большой твёрдостью.
В узлах ионной кристаллической решётки находятся положительные и отрицательные ионы, связь между ними ионная. Ионную кристаллическую решетку имеют соли, щёлочи и оксиды типичных металлов. Для веществ с ионной кристаллической решеткой характерны высокие температуры плавления, твёрдость, плотность, хорошая электропроводность.
В узлах молекулярной кристаллической решетки находятся молекулы, которые удерживаются за счет межмолекулярных вандервальсовых сил. Примером веществ с молекулярной кристаллической решеткой являются лёд, йод, нафталин, углекислый газ. Межмолекулярные связи значительно слабее ковалентных и ионных, поэтому для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, невысокая твёрдость, возможность возгонки (переход из твёрдого состояния в газообразное, минуя жидкое).
Для металлов характерна металлическая кристаллическая решётка, в узлах которой расположены положительно заряженные ионы металлов, а между ними свободно перемещаются валентные электроны (так называемый электронный газ). Для веществ с металлической кристаллической решеткой характерны механическая прочность, плавкость, ковкость, хорошая тепло- и электропроводность, металлический блеск.
Свойства кристаллических тел определяются не только характером связи между частицами, но и их взаимным расположением относительно друг друга. В кристаллах алмаза все атомы углерода связаны ковалентными неполярными связями и находятся на одинаковом расстоянии друг от друга, образуя тетраэдры. В кристаллах графита каждые шесть атомов углерода связаны ковалентными неполярными связями, а между собой такие плоские шестиугольники связаны слабыми межмолекулярными связями.
Причины многообразия веществ
Не только углерод может образовывать разные вещества в зависимости от типа кристаллической решётки. Известно несколько веществ, образованных фосфором (белый, красный, чёрный и металлический фосфор). Сера может существовать в виде трёх модификаций (ромбическая, моноклинная и пластическая). Явление существования нескольких простых веществ, образованных одним и тем же элементом, называется аллотропией (полиморфизмом), а сами простые вещества – аллотропными (полиморфными) модификациями.
Существование изотопов – атомов одного и того же химического элемента, имеющих разные массовые числа - ещё одна причина огромного многообразия веществ.
Изучая органическую химию, вы узнали о существовании изомеров – молекул, имеющих одинаковый состав, но разную последовательность атомов и их расположение в пространстве. Изомеры встречаются не только среди органических соединений, например, изомером карбамида является цианат аммония.
Причиной разнообразия органических соединений является и гомология – существование ряда соединений, имеющих одинаковое строение и химические свойства, но отличающихся друг от друга на целое число групп СН2-.
118 известных на сегодняшний день химических элементов образуют миллионы различных веществ, но человек искусственным путём создает новые вещества с нужными ему свойствами. Создание человеком новых веществ получило название химического синтеза.
Таким образом, явления аллотропии (полиморфизма), изомерии, изотопии, гомологии, химический синтез новых соединений являются причинами многообразия веществ.
12.10.2022
11 класс
Дорогие ребята!
Поздравляем
вас с участием в обучающей открытой ученической олимпиаде по химии. Отвечая на
вопросы и выполняя задания, не спешите, так как ответы не всегда очевидны и
требуют применения не только химических знаний, но и общей эрудиции, логики и
творческого подхода. Желаем вам удачи!
Внимание! Задания выполняем на двойных листиках. Фотографии высылаем до 16-00 на мою почту.
I уровень
1. Из предложенных химических элементов алюминий,
хлор, фосфор, бор, определите атом, который в невозбужденном состоянии содержит
три не спаренных электрона:
1) алюминий; 2) хлор; 3)
фосфор; 4) бор
(написать схему строения атома этого химического
элемента). (4 балла)
2. Укажите, какое из предложенных водородных
соединений может образовать элемент,
электронная конфигурация атома которого 1s22s22p63s23p2.
а)
NH3;
б) SiH4; в) H2S; г) HCl. (4 балла)
3. Состав драгоценного
камня изумруда описывает формула BexAl2(SiO3)6.
Исходя из электронейтральности
вещества, определите и укажите индекс x в
этой формуле. (4 балла)
4.Определите какая реакция
является окислительно-восстановительной:
а) CaO + SO2 = CaSO3
б) Cu(OH)2 =
CuO + H2O
в) S
+ O2 = SO2
г) H2SO4
+ BaCl2 = BaSO4 + 2HCl .(4 балла)
5. Укажите, какой из оксидов обладает наиболее выраженными основными
свойствами: а) Mn2O7,
б) Mn2O3, в) MnO,
г) MnO2. .(4 балла)
6. Укажите тип кристаллической решетки в бинарном соединении
химических элементов с протонными числами 11 и 8. (4 балла)
7.
Напишите формулу кислоты,
образованной элементом, которому соответствует высший оксид состава Э2О5.
(4 балла)
8. Какая из предложенных молекул
имеет наиболее прочную химическую связь в молекуле?
а) Н2, б) N2, в) F2, г) О2 (4 балла)
9. Какое
водородное соединение окрашивает водный
раствор лакмуса в синий цвет?
а) CH4, б) NH3, в) H2O, г) HCl
(4 балла)
Всего 36 баллов
II
уровень
1.Газ А, который используют при резке и сварке металлов, смешали со взрывоопасным
газом В в молярном соотношении 1:1 и пропустили при нагревании над платиновым катализато-ром
(реакция 1). Получился газ С, который используют для ускорения
созревания плодов. Газ С
пропустили через раствор D желтого цвета, который в процессе взаимодействия с газом С
обесцветился (реакция 2). При пропускании газа С через розовый раствор вещества Е также
наблюдается обесцвечивание раствора и образуется вещество F
(реакция 3), используемое для
изготовления незамерзающих смесей (антифриз).
- Определите вещества А-F, приведите их названия по номенклатуре ИЮПАК, для веществ А, С
и F составьте
структурные формулы.
- Составьте уравнения описанных реакций 1-3
(используйте структурные формулы).
(15
баллов)
2.Составьте уравнения реакций
по схеме:
Сu → CuSO4→ Cu(OH)2→ Cu2O → CuO (каждая правильная реакция 3 балла;
итого 12 баллов)
3. Реакция при
температуре 600С завершается за 1 мин 20 с. Через какое время
завершится эта реакция при температуре 800С, если в этом
температурном интервале температурный коэффициент скорости реакции равен 3
? (8 баллов)
4. В результате сгорания 1
моль бензола выделяется 3301,2 кДж теплоты. Составьте термохимическое уравнение
реакции и рассчитайте какое количество теплоты
выделится в результате сгорания 195 г бензола. (9 баллов)
Всего 44 балл
III уровень
1. Какова
масса кристаллогидрата Na2SO4 × 10 H2O,
которая останется после испарения 3 кг
10 %-ного по массе раствора сульфата натрия? (10 баллов)
2. При полном сгорании
органического вещества массой 3,48 г получено 11,16 г смеси углекислого газа и
воды, в которой количество углекислого газа равно количеству воды.
Относительная плотность
сгоревшего вещества по водороду равна 29.
Определите молекулярную формулу
сгоревшего вещества. (10 баллов)
Всего 20 баллов
Итого: 100 баллов.
06.10.2022
Тема: Типы кристаллических решеток.
Цель: Расширить знания о типах кристаллических решеток.
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
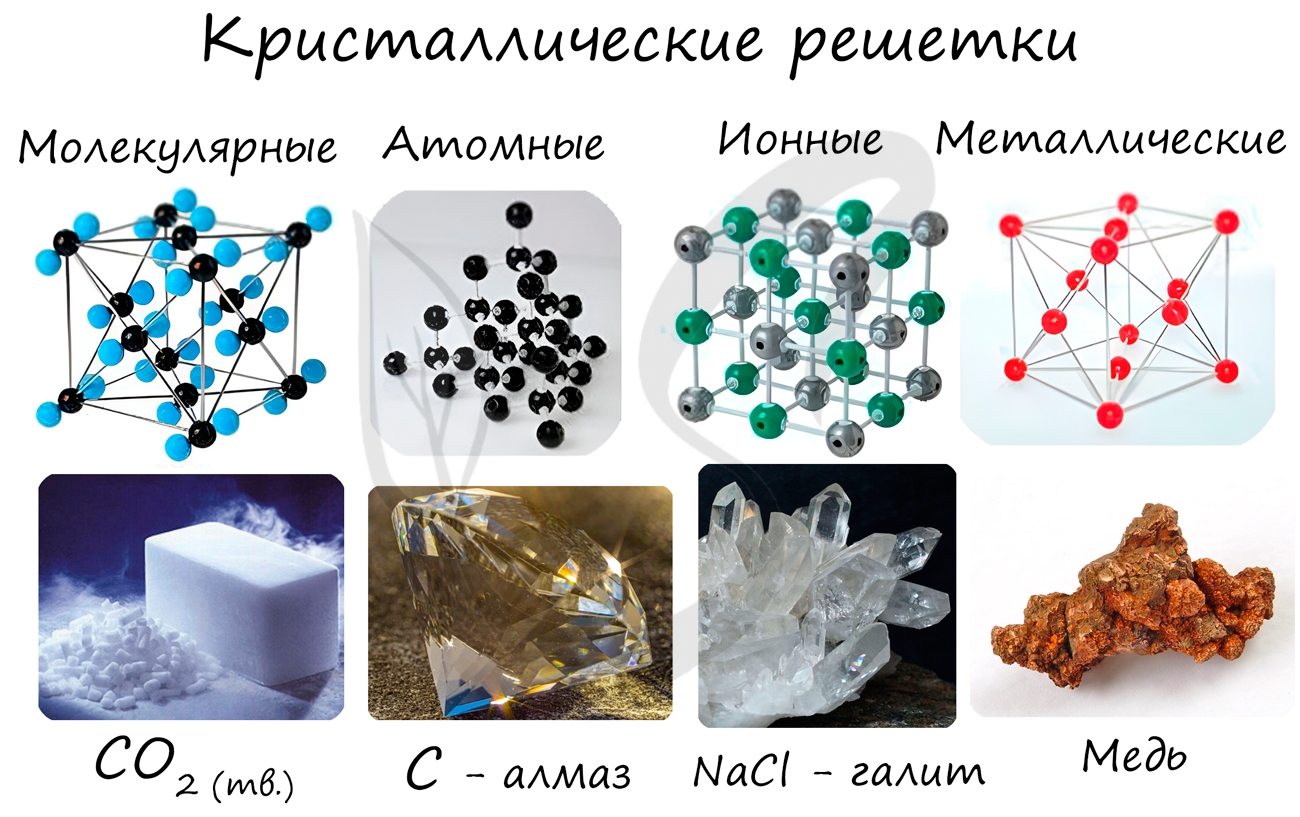
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью - NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

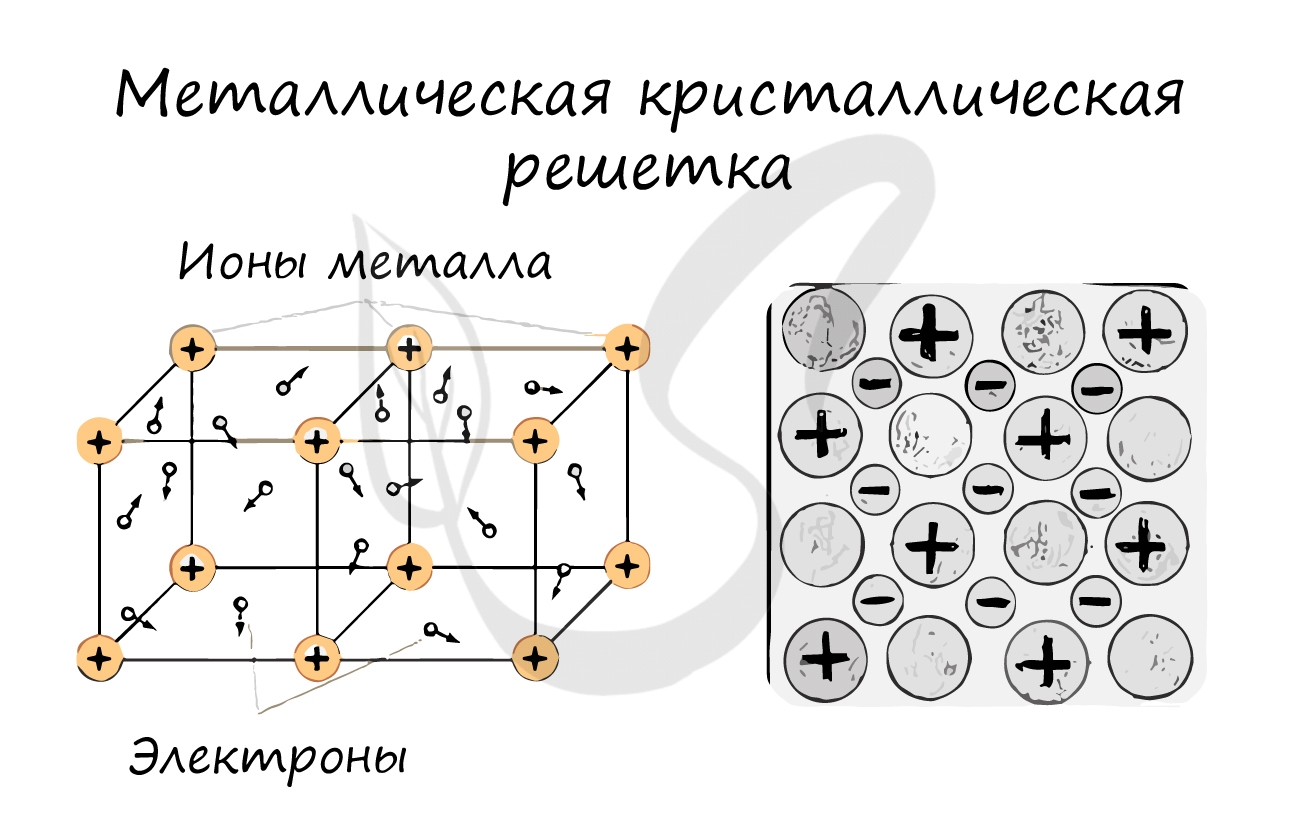
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

Ссылка на видео: https://yandex.fr/video/preview/8017613196842539195
Домашнее задание: Сделать краткий конспект урока.
Выполнить тестовые задания:
1. Вид частиц в ионной решетке:
а) ионы | в) молекулы |
б) атомы | г) атом-ионы |
2. Характер химической связи в атомной решетке:
а) металлическая | в) ионная |
б) ковалентная | г) сила межмолекул. взаимодействия |
3. Прочность связи в молекулярной решетке
а) очень прочная | в) слабая |
б) прочная | г) разной прочности |
4. Агрегатное состояние у веществ с ионной решеткой:
а) твердое | в) жидкое |
б) газообразное |
5. Очень тугоплавкими являются вещества с решеткой:
а) металлической | в) атомной |
б) молекулярной | г) ионной |
6. Пластичностью обладают вещества с:
а) металлической | в) молекулярной |
б) ионной | г) атомной |
7. Кремний имеет решетку:
а) молекулярную | в) ионную |
б) атомную | б) металлическую |
8. Щелочи имеют решетку:
а) молекулярную | в) ионную |
б) металлическую
9. Вода имеет решетку:
а) молекулярную | в) ионную |
б) атомную | б) металлическую |
29.09.2022
Тема: Строение молекул.
Цели урока: Показать зависимость геометрии молекул от типа гибридизации электронных орбиталей, а свойства веществ от геометрии молекул. Раскрыть универсальный характер процесса гибридизации для органических, сложных неорганических веществ и аллотропных модификаций углерода. Обратить внимание на влияние фундаментальных законов природы и особенностей строения молекул на существующий порядок и красоту в мире.
Домашнее задание: Прочитать § 7. Выполнить задания № 5 стр. 41, № 1 стр. 42 (электронный учебник).
22.09.2022
Тема: Химическая связь.
Химическая связь — это взаимодействие атомов, осуществляемое путём обмена электронами или их перехода от одного атома к другому.
Причиной образования химической связи является стремление системы к более устойчивому состоянию с минимально возможным запасом энергии. При образовании химической связи атомы стремятся приобрести устойчивую электронную оболочку.
Химическая связь имеет единую природу. Причиной единства всех типов и видов химических связей служит их одинаковая физическая природа — электронно-ядерное взаимодействие.
Различают четыре основных вида химической связи: ковалентную, ионную, металлическую и водородную.
Ковалентная химическая связь — связь, возникающая в результате образования общих электронных пар.
Ионная связь — это связь, которая возникает между атомами, сильно различающимися по значениям электроотрицательности. Ионы — это заряженные частицы, образующиеся из нейтральных атомов или молекул путём отдачи или присоединении электронов. Ионы могут также состоять из группы атомов. Положительно заряженные ионы называются катионами, отрицательно заряженные — анионами
Металлическая связь — это связь между положительными ионами металлов и общими электронами, которые свободно движутся по всему объёму.
Водородная связь — это связь между атомом водорода, ковалентно связанным с другим электроотрицательным атомом.
Видеоролик: https://www.youtube.com/watch?v=3ArLPn7EmNA
 Домашнее задание
Домашнее задание
- 1. Охарактеризуйте донорно-акцепторный механизмы образования ковалентной связи.
- 2. Опишите сходство и различие химических связей в молекулах фтора и фтороводорода.
- 3. Сопоставьте свойства ковалентной и ионной связи.
- 4. Охарактеризуйте физические свойства металлов, обусловленные наличием металлической связи.
- 5. Определите тип химической связи в следующих соединениях:
.
08.09.2022
Тема: Периодическая система химических элементов
Д.И. Менделеева.
Ключевые слова конспекта: Периодическая система химических элементов Д.И. Менделеева, группы и периоды Периодической системы, физический смысл порядкового номера химического элемента.
Периодическая система химических элементов — это таблица, в которой все химические элементы расположены в порядке возрастания атомных номеров. Таблица включает в себя периоды и группы, т.е. горизонтальные строчки и вертикальные столбцы.
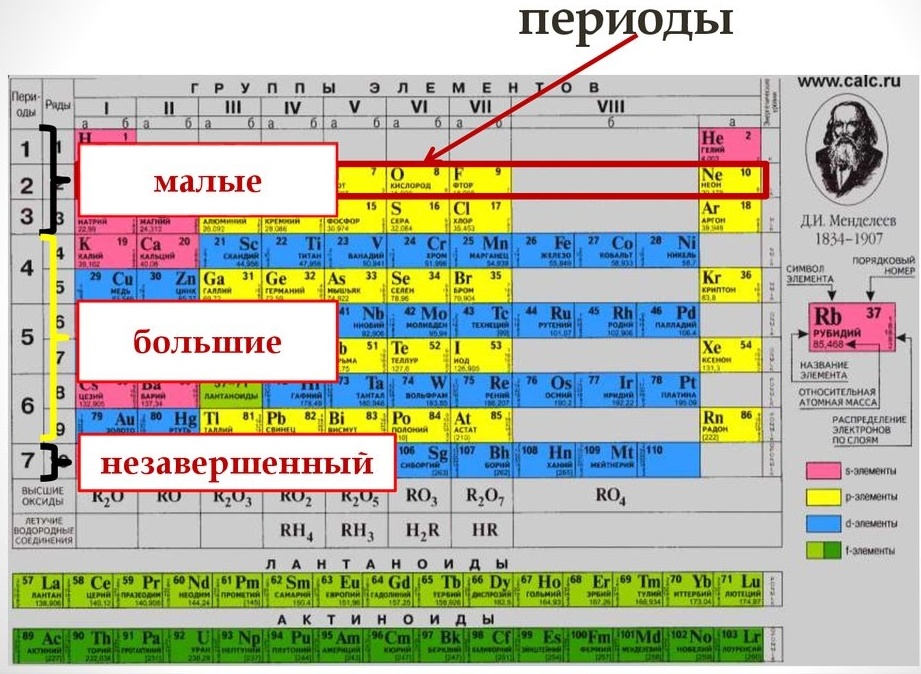
Период — это последовательность (горизонтальный ряд в таблице) элементов с возрастающими атомными номерами, начинающаяся щелочным металлом (или водородом) и заканчивающаяся благородным газом.
Число электронных слоев в атомах данного периода равно номеру периода.
В периодах с возрастанием атомного номера Z металлические свойства ослабевают, а неметаллические усиливаются.
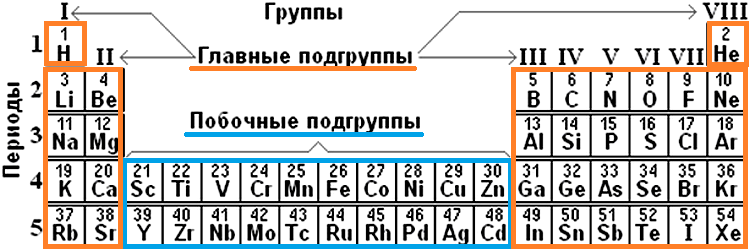
Группа — это вертикальная колонка элементов в таблице, включающая элементы с одинаковой максимальной степенью окисления, равной номеру группы, и одинаковой отрицательной степенью окисления, для атомов неметаллов равной номеру группы минус 8.
В группах с возрастанием атомного номера Z металлические свойства усиливаются, а неметаллические ослабевают. Число валентных электронов атома обычно равно номеру группы.
В коротком варианте таблицы Менделеева различают малые периоды — 1-й, 2-й и 3-й, содержащие 2, 8 и 8 элементов соответственно, а также большие периоды — 4-й, 5-й, 6-й и незавершенный 7-й. Каждый большой период таблицы включает две строчки (два ряда). Например, в 4-м периоде, начинающемся калием 19K, последний элемент в верхней строчке — никель 28Ni, он в числе элементов триады (Fe, Со, Ni) попадает в VIII группу. Следующий элемент — медь 29Cu записан строчкой ниже и находится в I-й группе.
Каждая группа с номерами от I до VIII включает две группы — А и Б.
A-группы включают элементы малых периодов, а также элементы больших периодов, которые по свойствам наиболее близки к соответствующим элементам малых периодов.
Б-группы включают элементы больших периодов, в атомах которых электроны, появляющиеся в них с увеличением заряда ядра, попадают в слой, предшествующий внешнему.
Физический смысл порядкового номера химического элемента:
- это число нейтронов в атоме;
- это относительная атомная масса;
- это число энергетических уровней в атоме;
- это число протонов в ядре.

Домашнее задание:
Выполнете задания № 5, 7 стр.22 (электронный учебник).
01.09.2022
Электронный учебник: https://cloud.mail.ru/public/81Dg/rTiwiDeXq
Электронный задачник: https://obuchalka.org/201012167104/gotovie-domashnie-zadaniya-po-himii-11-klass-k-uchebniku-himiya-11-klass-rudzitis-g-e-feldman-f-g.html
Завести 1 рабочую тетрадь (38 листов), 1 тетрадь для практических работ (12 листов).
Тема: Строение вещества.
Посмотрите видео по ссылке:
https://www.youtube.com/watch?v=iDRq9KJAUYE
https://www.youtube.com/watch?v=kqHYbT9rv6A
Внимательно прочитайте § 1. Сделайте краткий конспект урока.
Домашнее задание: Выполнить задания № 1-3 стр. 6.
Внимание!
Задания высылать на почту: shoshin981@gmail.com
Указывать дату урока. Фамилию Имя, класс, название предмета.
Удачи!
Комментариев нет:
Отправить комментарий