Внимание!
Доброе утро! С 07.11.2022 г.
Все уроки будут выкладываться в группе Вконтакте.
Там же будут выкладываться ссылки на Телемост по расписанию. Присутствие на уроке строго обязательно!
Ссылка: https://vk.com/club216978964
27.10.2022
Доброе утро.
Ссылка на Яндекс Телемост.6-й урок начнется по расписанию.Просьба внимательно следить за расписанием и предупреждать классного руководителя в случае возникновения проблем со связью.
Тема: Относительная атомная масса. Относительная молекулярная масса.
Цель урока - познакомиться с написанием химических формул и определением относительной атомной и молекулярной массы.
Химическая формула – это условная запись, выражающая количественный и качественный состав вещества.
Качественный состав показывается с помощью символов химических элементов, а количественный – с помощью индексов.
Индекс – число атомов данного химического элемента в формуле вещества.
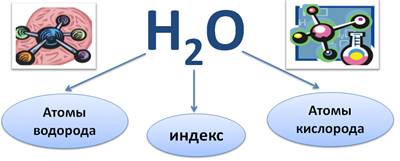
Формула воды Н2О. Что же показывает формула воды?
Посмотрите, в её составе атомы Н (химический символ водорода Н) и атомы О (химический символ кислорода О). Кроме того, в формуле есть цифра 2, которая стоит справа от химического символа, её называют индексом. У кислорода индекс 1, но индекс 1 не пишется в формуле. Индекс показывает число атомов данного химического элемента в химической формуле.
С помощью химических формул мы можем судить о количественном и качественном составе веществ.
Рассмотрим молекулу кислорода. В её составе 2 атома кислорода (посмотрите, они одинаковы по цвету и размеру), что можно изобразить в виде формулы – О2.
Другая молекула – это молекула воды, в её составе 2 атома водорода и 1 атом кислорода. Это выражается в формуле Н2О.
Третья формула отображает состав двух молекул воды, что можно выразить в виде формулы 2Н2О. Двойка перед химической формулой отражает число молекул. Эта цифра называется коэффициентом.
Состав вещества
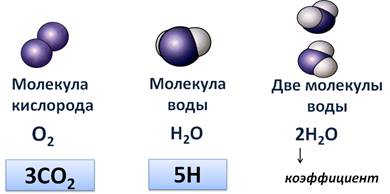
Например, нужно записать в виде формулы 3 молекулы углекислого газа, значит эта формула будет иметь вид 3СО2, пять атомов водорода, то 5Н.
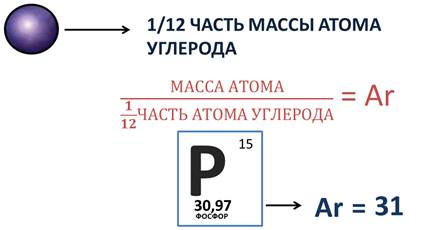
Массы атомов очень малы. И для простоты расчётов ввели относительную величину. За эталон сравнения взяли 1/12 часть массы атома углерода. Разделив массы атомов химических элементов на 1/12 часть массы атома углерода, получили значения относительных атомных масс, которая обозначается буквой Ar, где r означает «относительный» в переводе с английского. И раз эта величина относительная, то она не имеет единиц измерения. Значения относительных атомных масс приведены в периодической системе, и при расчётах округляются до целого значения. Например, относительная атомная масса фосфора 31, т.к. после 30 идёт цифра 9.
Рассмотрим, как определяется относительная молекулярная масса. Она обозначается буквой Mr, (М, потому что молекулярная, r означает, что она относительная и также не имеет единиц измерения). Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих данную молекулу.
Например, вам необходимо рассчитать относительную молекулярную массу воды. В её состав входят 2 атома водорода и 1 атом кислорода, относительная молекулярная масса воды вычисляется как сумма относительных атомных масс водорода и кислорода с учётом индексов.
Mr (H2O) = Ar (H) ∙ 2 + Ar (O) ∙ 1 = 1 ∙ 2 + 16 ∙ 1 = 18
Зная химическую формулу вещества можно рассчитать и массовые доли элементов в веществе с помощью следующей формулы:
ω(э) = 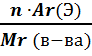
ɷ (э) – массовая доля элемента Э в веществе;
n – число атомов элемента Э в веществе;
Ar (Э) – относительная атомная масса элемента Э;
Mr (в-ва) – относительная молекулярная масса вещества.
Рассчитаем массовые доли водорода и кислорода в молекуле воды:
Относительную молекулярную массу мы находили ранее, она равна 18.
Массовая доля водорода равна:
ω(Н) = 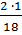 = 0,1111, или 11,11%
= 0,1111, или 11,11%
ω(О) = 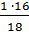 = 0,8889, или 88,89%
= 0,8889, или 88,89%
Сумма долей должна быть равна 1, а процентов 100, у нас эти показатели совпадают, значит, решение верно.
Домашнее задание: §11, 14, рассчитать Mr (KNO3), Mr (HCl), Mr(ZnS).
25.10.2022
Доброе утро. Ребята, выполняем задания олимпиады по физике. Оформляем на двойных листиках. Фото высылаем на мою почту.
Задания
школьного этапа Республиканской олимпиады школьников
образовательных организаций Донецкой Народной Республики
в 2022-2023 учебном году
по физике
8 класс
1. Сколько времени мимо мотоциклиста, следующего со скоростью 63км/ч, будет проезжать встречная колонна автомобилей длиной 300м, имеющая скорость 45 км/ч?
2. Какой станет длина пружины при нулевом положении указателя динамометра, если под действием силы 2Н длина пружины стала равной 4см, а под действием силы 4Н - равной 6см?
3. 2/3 угла между падающим и отражённым лучами составляет 80°. Определите угол падения луча
4. На нагревание кирпича массой 4 кг на 63°С затрачено такое же количество теплоты, как и для нагревания воды той же массы на 13,2°С. Определите удельную теплоёмкость кирпича. Удельная теплоёмкость воды 4200 Дж/кг° С.
5. Водяной насос подаёт 300 л воды в минуту на высоту 20м. Определите мощность двигателя насоса, если его КПД равен 80%.
Критерии оценивания решений задач (в баллах)
21.10.2022
Работу выполняем в тетрадях для контрольных работ. Не забываем верно оформлять расчетные задачи (Дано, Найти, Решение, Ответ).
Тема:
Контрольная работа №1.
Тема «Внутренняя энергия. Количество теплоты»
Вопрос 1
Если тело охлаждается, то его внутренняя энергия...
Вопрос 2
Снег на ладони тает за счет
Варианты ответов
- совершения работы
- конвекции
- теплопроводности
- совершения работы и теплопередачи
- излучения
Вопрос 3
Солнце обогревает Землю. Основным видо теплопередачи в этом случае является...
Вопрос 4
Наибольшей теплопроводностью обладают
Варианты ответов
- жидкости
- газы
- твердые тела
- жидкости и газы
Вопрос 5
Удельная теплоемкость льда 2100 Дж/(кг оС). Это означает, что
Варианты ответов
- при нагревании любой массы льда на 1 градус потребуется количество теплоты 2100 Дж
- Любой массе льда при 0 градусов сообщается количество теплоты 2100 Дж
- 1 кг льда при 0 градусов выделяет количество теплоты 2100 Дж
- для нагревания 1 кг льда на 1 градус потребуется количество теплоты 2100 Дж
Вопрос 6
Горячая вода отличается от холодной тем, что
Варианты ответов
- молекулы горячей воды имеют большие размеры
- молекулы холодной воды имеют большие размеры
- молекулы горячей воды движутся быстрее
- молекулы холодной воды движутся быстрее
Вопрос 7
На рисунке представлены графики зависимости температуры от времени трех тел одинаковой массы. Удельная теплоемкость меньше
Варианты ответов
- у первого тела
- у второго тела
- у третьего тела
Вопрос 8
Какое количество теплоты пойдет на нагревание железа массой 200 г от 20 оС до 220 оС? Удельная теплоемкость железа 460 Дж/(кг оС). Ответ запишите в кДж только число без единиц измерения.
Вопрос 9
При сгорании торфа выделилось 70 000 кДж энергии. Какая масса торфа сгорела?. Удельная теплота сгорания торфа 1,4 * 107 Дж/кг. Ответ запишите в кг , указав только числовое значение.
Вопрос 10
На нагревание воды от 30 оС до 90 оС пошло количество теплоты 126 кДж. Удельная теплоемкость воды 4200 Дж/(кг оС). Чему равна масса нагретой воды? Ответ запишите в граммах в виде чила без единиц измерения..
13.10.2022
Тема: Валентность атомов химических элементов.
Цели урока: опираясь на знания, повторить понятия “химическая формула”; способствовать формированию у учащихся понятия “валентность” и умению определять валентность атомов элементов по формулам веществ.
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность обозначается римскими цифрами.
Записи на доске и в тетрадях:
I I | I II | I III | I IV |
Валентность атома водорода принята за единицу, а у кислорода – II.
Эволюция понятия “валентность” (сообщение учащегося).
– В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
В конце 50-х гг. XIX вeка А.С. Купер и А.Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г. вскрыл зависимость валентности элемента от его положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В.Гейтлер и Ф.Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода H2.
Определение валентности атомов элементов в соединениях.
Правило определения валентности: число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента.
Алгоритм определения валентности.
Алгоритм определения валентности | Пример | |
1. Запишите формулу вещества. | H2S, Cu2O | |
2. Обозначьте известную валентность элемента | I | II |
3. Найдите число единиц валентности атомов известного элемента, умножив валентность элемента на количество его атомов | 2 | 2 |
4. Поделите число единиц валентности атомов на количество атомов другого элемента. Полученный ответ и является искомой валентностью | 2 | 2 |
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
Домашнее задание: Прочитать § 16, 17.
Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). Задание в раздаточном материале.
SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
Выполнить Задание № 5 стр. 60.
06.10.2022
Тема: Атомно-молекулярное учение.
Цели: - Обобщить знания учащихся об атомах и молекулах; об атомно – молекулярном учении, опираясь на знания учащихся, полученных в курсе физики и химии; - систематизировать знания учащихся о развитии и создании атомно-молекулярной теории, о работах учёных в области атомно-молекулярной теории; - научить учащихся анализировать физические и химические явления и уметь объяснять их сущность с точки зрения атомно-молекулярного учения.
 Атомно-молекулярное учение впервые было разработано в 18 веке великим русским ученым М.В. Ломоносовым. В 1741 году он предоставил основные положения своего атомно-молекулярного учения научным кругам в сочинении «Элементы математической химии». После смерти М.В. Ломоносова и вплоть до наших дней учение претерпело ряд изменений по форме, но никогда - по содержанию.
Атомно-молекулярное учение впервые было разработано в 18 веке великим русским ученым М.В. Ломоносовым. В 1741 году он предоставил основные положения своего атомно-молекулярного учения научным кругам в сочинении «Элементы математической химии». После смерти М.В. Ломоносова и вплоть до наших дней учение претерпело ряд изменений по форме, но никогда - по содержанию.
В настоящее время основные положения атомно-молекулярное учение звучат следующим образом:
1. Все вещества на нашей планете состоят из молекул. Молекула – система или группа атомов, имеющая ярко выраженные химические свойства.
2. Все молекулы состоят из атомов. Атомы - конечные составные части химических элементов, обладающие химическими свойствами. Каждый химический элемент состоит из присущего только ему набору атомов.
3. Все молекулы и атомы за счет постоянного отталкивания и притяжения находятся в постоянном движении.
4. Молекулы простых веществ имеют в своем составе одинаковые атомы, молекулы сложных веществ – различные атомы.
Впервые атомно-молекулярное учение М.В. Ломоносова было применено английским химиком Дж. Дальтоном в 1808 году. В своей книге «Новая система химической философии» он попытался применить учение Ломоносова для осознания строения молекул и атомов. Но подлинное научное признание к атомно-молекулярному учению пришло спустя еще 50 лет. В 1860 году на Международном съезде химиков в городе Карлсруэ (Германия) основные положения учения были признаны и основными положениями химии.
В настоящее время атомно-молекулярное учение обрело свои границы. Оно действительно только для веществ в газообразном и парообразном состоянии. Для веществ в твердом состоянии оно действительно только в том случае, если кристаллическая решетка имеет молекулярную структуру. Большинство твердых веществ ее не имеют. К таким веществам относятся все соли, металлы, оксиды металлов, из отдельных веществ – алмаз и кремний.
Ссылка на видео: https://www.youtube.com/watch?v=V3E2XtKjYC8
Домашнее задание:
Прочитать § 7.
Выполнить задания № 5-8 стр. 28
04.10.2022
Тема: Символы химических элементов.
В химии очень важным является понятие «химический элемент» (слово «элемент» по-гречески означает «составная часть»). Чтобы понять его сущность, вспомните, чем различаются смеси и химические соединения.
Например, железо и сера свои свойства в смеси сохраняют. Поэтому можно утверждать, что смесь порошка железа с порошком серы состоит из двух простых веществ — железа и серы. Так как химическое соединение сульфид железа образуется из простых веществ — железа и серы, то хочется утверждать, что сульфид железа тоже состоит из железа и серы. Но познакомившись со свойствами сульфида железа, мы понимаем, что этого утверждать нельзя. Это сложное вещество, образовавшееся в результате химического взаимодействия, обладает совершенно другими свойствами, нежели исходные вещества. Потому что в состав сложных веществ входят не простые вещества, а атомы определённого вида.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — это определённый вид атомов.
Так, например, все атомы кислорода независимо от того, входят ли они в состав молекул кислорода или в состав молекул воды, — это химический элемент кислород. Все атомы водорода, железа, серы — это соответственно химические элементы водород, железо, сера и т. д.
В настоящее время известно 118 различных видов атомов, т. е. 118 химических элементов. Из атомов этого сравнительно небольшого числа элементов образуется огромное многообразие веществ. (Понятие «химический элемент» будет уточнено и расширено в дальнейших конспектах).
Пользуясь понятием «химический элемент», можно уточнить определения простых и сложных веществ: ПРОСТЫМИ называют вещества, которые состоят из атомов одного химического элемента. СЛОЖНЫМИ называют вещества, которые состоят из атомов разных химических элементов.
Следует различать понятия «простое вещество» и «химический элемент», хотя их названия в большинстве случаев совпадают. Поэтому каждый раз, когда мы встречаем слова «кислород», «водород», «железо», «сера» и т. д., нужно понимать, о чём идёт речь — о простом веществе или о химическом элементе. Если, например, говорят: «Растворённым в воде кислородом дышат рыбы», «Железо — это металл, который притягивается магнитом», это значит, что речь идёт о простых веществах — кислороде и железе. Если же говорят, что кислород или железо входит в состав какого-либо вещества, то имеют в виду кислород и железо как химические элементы.
Химические элементы и образуемые ими простые вещества можно разделить на две большие группы: металлы и неметаллы. Примерами металлов служат железо, алюминий, медь, золото, серебро и др. Металлы пластичны, имеют металлический блеск, хорошо проводят электрический ток. Примерами неметаллов служат сера, фосфор, водород, кислород, азот и др. Свойства неметаллов разнообразны.
Знаки химических элементов
Каждый химический элемент имеет своё название. Для упрощённого обозначения химических элементов используют химическую символику. Химический элемент обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента. Так, водород (лат. hydrogenium — гидрогениум) обозначают буквой Н, ртуть (лат. hydrargyrum — гидраргирум) — буквами Hg и т. д. Предложил современную химическую символику шведский химик Й. Я. Берцелиус в 1814 году
Сокращённые буквенные обозначения химических элементов — это знаки (или символы) химических элементов. Химический символ (химический знак) обозначает один атом данного химического элемента.
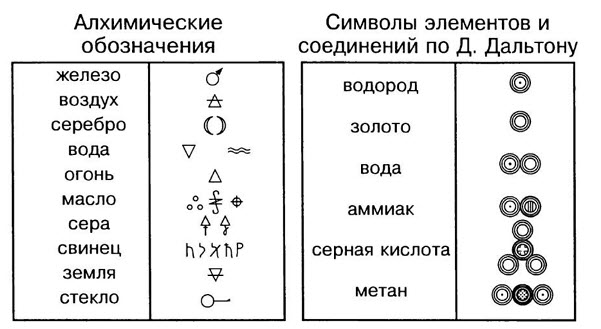
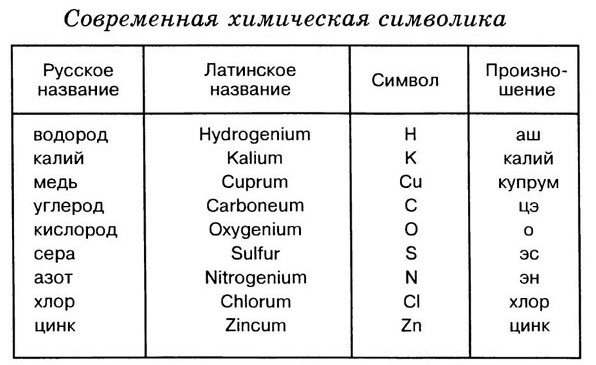
Домашнее задание:
Прочитать § 10, 12.
Выучить табл. 2, стр. 43.
Выполнить задания № 1-4, стр.44.
29.09.2022
Тема: Атомы и молекулы. Химические элементы.
Цель урока: формирование понятия молекула, атомом, химический элемент.
Ключевые слова конспекта: Атомно-молекулярное учение, атомы, молекулы и ионы, элементарные частицы, ядро, электрон, протон, нейтрон.
Древнегреческий философ Демокрит 2500 лет назад предположил, что все тела состоят из мельчайших, невидимых, неделимых, вечно движущихся частиц — атомов. В переводе «атом» означает «неделимый».
Учение о молекулах и атомах в основном было разработано в XVIII— XIX вв. Великий русский учёный М. В. Ломоносов утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). Многообразие веществ учёный объяснял соединением разных атомов в молекулах и различным расположением атомов в них.

Основоположником атомно-молекулярного учения принято считать известного английского учёного Джона Дальтона. Тем не менее некоторые представления об атомах и молекулах, высказанные Ломоносовым за полвека до Дальтона, оказались более достоверными, научными. Например, английский учёный отрицал возможность существования молекул, образованных одинаковыми атомами.
Атомно-молекулярное учение получило окончательное признание только в 1860 г. на Всемирном съезде химиков в Карлсруэ.
Молекулы
Каждое отдельно взятое вещество состоит из одинаковых молекул. Например, вещество вода состоит из молекул воды. Но размеры молекул воды очень малы, поэтому даже маленькая капелька воды содержит огромное количество молекул, которые имеют одинаковые состав и свойства.
Молекулы — это мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества. При химических реакциях молекулы распадаются, то есть они являются химически делимыми частицами. Молекулы состоят из атомов.

Атомы
Следует иметь в виду, что существуют также вещества, состоящие из отдельных одинаковых атомов. Мельчайшими частицами, сохраняющими характерные химические свойства таких веществ, являются атомы. Так, из отдельных атомов состоят благородные газы — гелий, неон, аргон и др. Атомы в отличие от молекул в ходе химических реакций не делятся на более мелкие части.
Атомы — это мельчайшие химически неделимые частицы вещества.
Элементарные частицы
В конце XIX—начале XX в. было обнаружено, что атомы состоят из ешё более мелких частиц. Эти частицы были названы элементарными частицами. В центре атома находится положительно заряженное ядро, вокруг которого находятся отрицательно заряженные частицы — электроны. Заряд электрона принято считать равным —1.
Ядро атома, в свою очередь, также состоит из элементарных частиц. В состав ядер атомов входят положительно заряженные частицы — протоны и частицы, имеющие почти такую же массу, как протоны, но не имеющие заряда,— нейтроны. Заряд протона численно равен заряду электрона, но имеет противоположный знак (+1).
Например, атом водорода состоит из ядра, в котором находится только один протон и один электрон. Атом гелия состоит из ядра, в котором находятся 2 протона и 2 нейтрона, а также 2 электрона. Атом лития состоит из ядра, в котором находятся 3 протона, 4 нейтрона, а также 3 электрона.
Ионы
Одни атомы, взаимодействуя с другими атомами, могут терять или, наоборот, приобретать один или более электронов. В результате электрически нейтральный атом превращается в заряженную частицу — ион. Если атом теряет один или несколько электронов, его называют положительно заряженным ионом. Атом, дополнительно присоединивший один или несколько электронов, называют отрицательно заряженным ионом. Противоположно заряженные ионы притягиваются друг к другу.
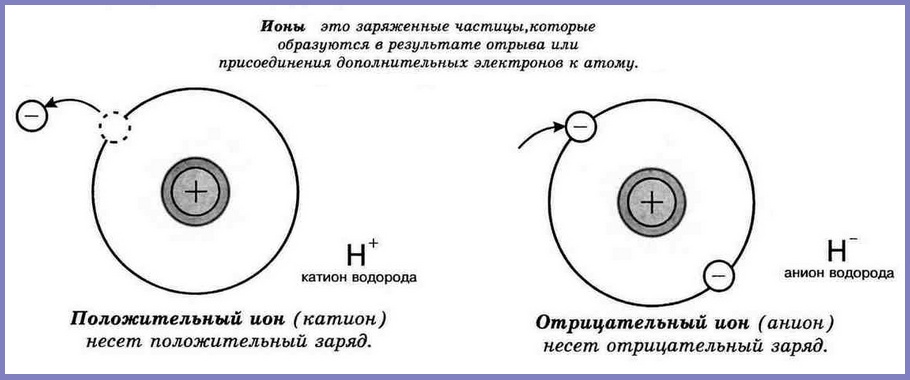
Домашнее задание: Прочитайте § 7. Сделайте краткий конспект урока.
Выполните задания № 3, 5, 6, 8 стр. 28.
22.09.2022
Практическая работа № 1.
Тема: Правила работы в лаборатории и
приёмы обращения с лабораторным оборудованием.
Практическая работа № 1. Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием.
Цель работы: Изучить правила техники безопасности при работе в химической лаборатории (кабинете), познакомиться с устройством и основными приёмами обращения с лабораторным оборудованием.
Оборудование: Штатив, спиртовка, пробирка, стакан с водой, лабораторная посуда.
Ход работы.
I. Правила техники безопасности при работе в химической лаборатории (кабинете).
II. Лабораторное оборудование.
Ход работы
1. Устройство лабораторного штатива.
Задание: рассмотреть и нарисовать штатив, обозначить его составные части.
2. Устройство спиртовки.
Задание: рассмотреть и нарисовать спиртовку, обозначить её составные
части.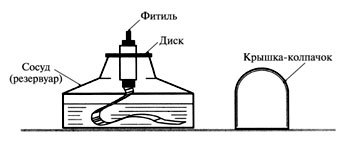
Правила работы со спиртовкой.
1.Снять колпачок
2.Проверить плотно ли прилегает диск к отверстию сосуда
3. Зажечь спиртовку горящей спичкой (НЕЛЬЗЯ ЗАЖИГАТЬ СПИРТОВКУ ОТ ДРУГОЙ ГОРЯЩЕЙ СПИРТОВКИ!)
4. Погасить спиртовку накрыв пламя колпачком.
Изучить строение пламени, сделать рисунок.
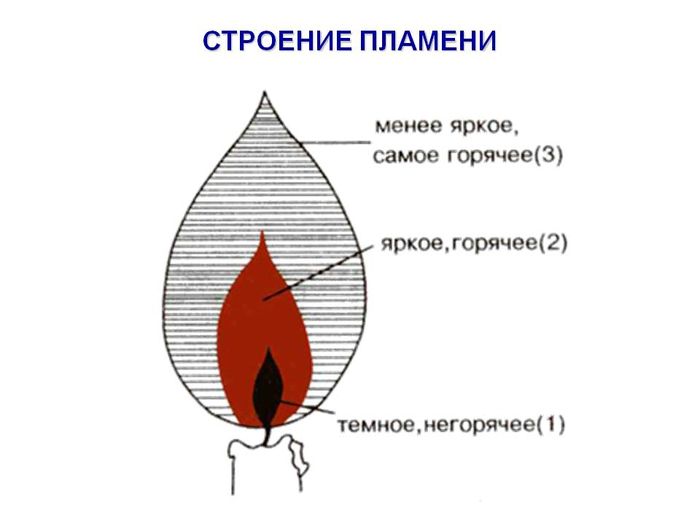
3. Химическая посуда.
Задание: рассмотреть и нарисовать образцы химической посуды.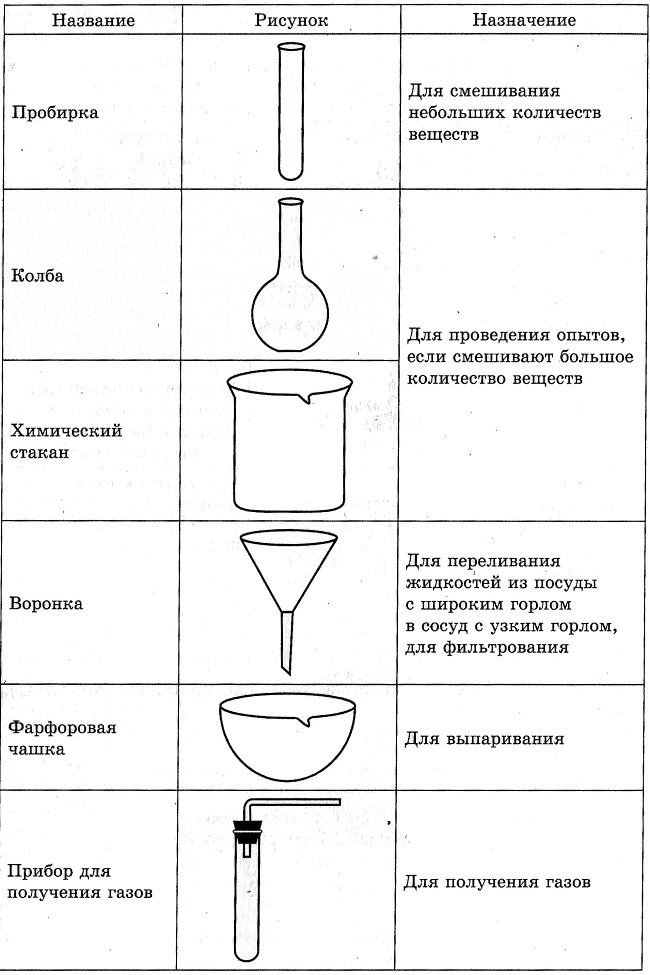
Сделайте выводы о проделанной работе.
Все записать и сделать рисунки в тетради для практических работ.
20.09.2022
Тема: Физические и химические явления. Химическая реакция и её признаки. Признаки и условия протекания химических реакций. Знакомство с правилами безопасности и приёмами работы в химической лаборатории.
Химические явления (реакции)
Всегда
ли вещества остаются неизменными? Нагреем красную медную проволоку в
пламени спиртовки. Проволока покрывается черным налетом, который можно легко
соскоблить ножом в виде черного порошка. Это уже новое вещество, в которое
превратилась медь. Оно отличается от меди по цвету и плотности. В этом
опыте мы наблюдаем химическое явление, которое происходит благодаря
химической реакции.
Химические реакции — это явления, при
которых происходит превращение одних веществ в другие.
Природа
— это огромная лаборатория, в которой непрерывно происходит образование
новых веществ. Горные породы и минералы под воздействием солнца, воды,
углекислого газа и других веществ постепенно разрушаются и превращаются в
новые вещества. В зеленых растениях из углекислого газа и воды образуются
глюкоза и крахмал.
Человек
превращает взятые из природы вещества (природный газ, нефть, руды) в
необходимые ему бензин, резину, пластмассы, волокна, металлы. Часто в
результате множества превращений получаются новые вещества, которых нет в
природе. При всех этих явлениях происходит разрушение исходных веществ и
образование новых веществ.
Например,
в результате сгорания магния образуется новое вещество MgO. При сгорании
метана получаются два вещества: углекислый газ CO2 и
вода H2O.
Ржавление
железа, кипячение воды, горение лучины, распространение запаха — какие из
этих явлений можно отнести к химическим реакциям? По каким признакам можно
судить, что химическая реакция произошла?
Признаки химических реакций
Проведем
несколько химических реакций. Нагреем в пробирке зеленый порошок
малахита — минерала, в состав которого
входят атомы меди, углерода, водорода и кислорода. Порошок малахита
начинает «кипеть» из-за выделяющегося газа. Поднесем к отверстию пробирки
спичку, она гаснет — это выделяющийся углекислый газ препятствует ее
горению. На стенках пробирки заметны капельки воды, на дне остается черный
порошок соединения меди (CuO). Наблюдения доказывают, что образуются
новые вещества с другими свойствами. Прекратим нагревание. Сразу
прекращается выделение углекислого газа — реакция больше не протекает.
Существуют
и другие признаки химических реакций. Например, при горении магния
излучается яркий свет и выделяется много теплоты.
На
заметку: Раньше вспышка магния использовалась для
освещения объекта во время фотографирования.
При
сливании некоторых растворов наблюдается выпадение осадка (рис. 54). Некоторые
осадки можно растворить при помощи других веществ. Например, при сливании
растворов соды и известковой воды образуется белый осадок, который легко
растворяется в уксусе.
При
сгорании спички ощущается резкий запах. Какие еще признаки химических
реакций наблюдаются при горении спички?
Изменения, происходящие с веществами, свидетельствуют о протекании химических
реакций и являются признаками химических реакций.
Признаки химических
реакций:
• Выделение газа.
• Образование или исчезновение осадка.
• Изменение цвета.
• Появление запаха.
• Излучение света.
• Выделение или поглощение теплоты.
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия.
Условия протекания химических реакций
Необходимое
и главное условие для протекания большинства реакций между различными
веществами — это их соприкосновение. Для обеспечения лучшего
контакта вещества измельчают, переводят в газообразное состояние. Многие
вещества лучше реагируют друг с другом, если они растворены в воде.
Во
многих случаях этого недостаточно, поэтому реагирующие вещества нагревают.
Деревянная лучинка, смесь железа и серы, медь могут долгое время
сохраняться при комнатной температуре, реакции начинаются только при их
нагревании.
Мало
знать, как начать химическую реакцию, надо еще знать, при каких условиях
она будет протекать дальше. Почему необходимо все время нагревать сахар,
чтобы добиться его полного сгорания, а деревянную лучинку зажигают один раз и
она продолжает гореть?
Если
при образовании новых веществ выделяется много теплоты, то ее бывает
достаточно, чтобы нагревались новые порции вещества и реакция
продолжалась. Во многих случаях реакции, начавшись, продолжаются за счет
теплоты, выделяемой в этих реакциях, не требуя дополнительной энергии.
Примером является горение угля. Другие реакции, например разложение
сахара, требуют постоянной затраты энергии на ее продолжение.
В
некоторых случаях для начала химического процесса необходимо освещение.
Одной из таких реакций, требующих постоянного освещения, является известная вам
реакция фотосинтеза.
Таким
образом, окружающий нас мир состоит из множества веществ, которые вступают в
различные химические реакции. Изучая химические реакции, человек познает
сущность процессов, протекающих в живой и неживой природе. Полученные знания
помогают более эффективно использовать вещества для получения больших
урожаев, выращивания животных, борьбы с различными болезнями. Человечество
учится бережно и грамотно относиться к окружающему нас миру.
Краткие
выводы урока:
- Химические реакции — это явления превращения
одних веществ в другие.
- О протекании химических реакций судят по
выделению газа, выпадению или исчезновению осадка, изменению цвета,
появлению запаха, поглощению или выделению теплоты и излучению света.
- Необходимым условием протекания большинства
химических реакций является соприкосновение реагирующих веществ.
Домашнее задание (письменно):
1.
Определите, какие из приведенных ниже
процессов относятся к физическим явлениям, а какие - к химическим превращениям,
и разместите их в таблице:
плавление парафина
горение
свечи
горение
парафина
разрезание
бумаги
упаривание
воды
плавление
льда
горение
магния
смешивание
железа и серы
передача
тепла
ржавление
железа
2.
Какие из приведенных ниже выражений не
применимы к смеси?
Образуется
в результате химической реакции.
Компоненты
сохраняют свои свойства.
Компоненты
могут быть разделены физическими методами.
Приготавливается
смешиванием двух или более компонентов.
3.
Для определения свойств серы провели серию
экспериментов. Какие из них являются примерами химических превращений?
плавление
при нагревании
измельчение
в ступке
горение
в пламени газовой горелки
определение
растворимости в воде
4.
Отметьте в данном списке только физические
явления:
плавление
парафина
горение
бумаги
ржавление
лезвия
горение
магния
растворение
соли
измельчение
серы
сжигание
угля
испарение
воды
5.
Обоснуйте утверждения:
1) Процесс выпаривания воды из раствора
соли – физическое явление, потому что... .
2) Перечисленные явления: горение свечи,
ржавление железа, гниение листьев, прокисание молока, подгорание масла – можно
объединить в одну группу, потому что... .
08.09.2022
Тема: Чистые вещества и смеси. Способы разделения смесей.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
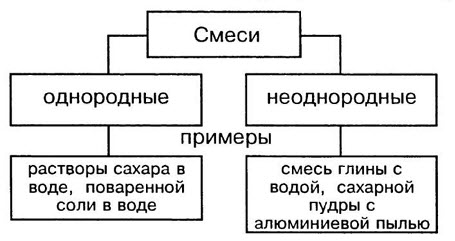
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
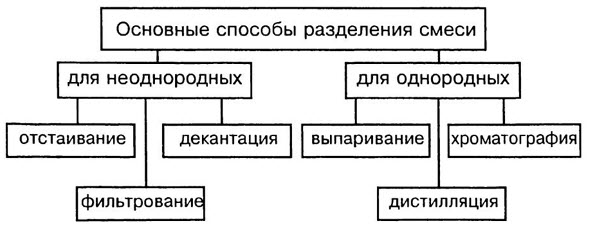
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Домашнее задание:
Сделайте краткий конспект урока.
Выполните следующие задания:
Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) муки от попавших в неё железных опилок;
2) воды от растворённых в ней неорганических солей?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) поваренной соли от попавших в неё железных опилок;
2) воды от мелких частиц карбоната кальция?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
06.09.2022
Тема: Физические свойства веществ. Тела и вещества. Агрегатное состояние веществ.
Все вещества при нормальных условиях могут находиться в трёх cсостояниях: твёрдом, жидком и газообразном. Такие состояния веществ называют агрегатными.
Например, при нормальных условиях вода находится в жидком агрегатном состоянии, при температуре 0 0С вода находится в твёрдом агрегатном состоянии (это всем известный лёд). Ледяной узор на стекле, снег и гигантский айсберг – это всё твёрдое агрегатное состояние воды.

Если воду нагреть до температуры 100 0С, то она переходит в газообразное состояние, так называемый пар. Этот пар представляет собой скопление мельчайших водяных капелек. Облака – это миллиарды мельчайших капелек воды.
Большинство газообразных веществ бесцветны, поэтому увидеть их невозможно. Находясь в сосуде, они принимают его форму. Объём газов зависит от температуры и давления, поэтому газы сжимаемы. Это свойство широко используется. Например, с помощью сжатого воздуха закрываются и открываются двери в автобусе, поток раскалённых газов реактивного двигателя поднимает ввысь самолёты, купол парашюта, наполненный упругим воздухом, позволяет плавно опуститься на землю.
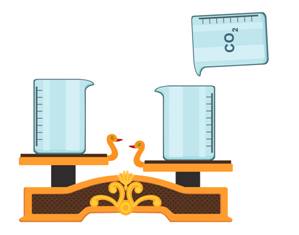
Однако эта «невесомость» газов – понятие относительное. Например, на двух чашах уравновешенных весов стоят одинаковые химические стаканы. Визуально мы не увидим здесь газы. Углекислый газ легко можно «перелить» из сосуда в сосуд. Если взять стакан с углекислым газом и «перелить» его в один из стаканов, то чаша весов опускается вниз. Углекислый газ заполняет стакан и вытесняет воздух из него, поэтому чаша весов опустилась. Из этого можно сделать вывод, что углекислый газ тяжелее воздуха.
Несомненно, переливать жидкости более привычно и наглядно. Если жидкость налить в сосуд, то она примет форму того сосуда, в который её налили. Это отражает такое свойство жидкости, как текучесть. Одни жидкости достаточно быстро растекаются по плоской поверхности, например, вода, спирт, бензин, ацетон. Другие жидкости – очень медленно. Так, капля мёда на стекле будет растекаться очень медленно, для того, чтобы это сделать, нужно стекло поставить вертикально. Жидкости, в отличие от газов, практически не сжимаются. Если хлопнуть по поверхности воды, то эффект будет таким же, как, если хлопнуть по крышке стола.
Если жидкость охладить, то она переходит в твёрдое агрегатное состояние. Твёрдые тела сохраняют свои объём и форму, они практически не сжимаются. Так, кубики льда постоянно буду иметь свои форму и объём, куда бы мы их не перемещали, пока они не растают.
Диффузию, броуновское движение, переход веществ из одного агрегатного состояния в другое относят к физическим явлениям, так как не происходит превращения одних веществ в другие.
Таким образом, физические явления – это явления, при которых изменяются агрегатные состояния веществ, форма и размеры тел, построенных из этого вещества, но сохраняется их химический состав.
В газообразных веществах расстояние между молекулами в десятки раз превышает размер самих молекул, поэтому они слабо связаны друг с другом и газы легко сжимаются. В твёрдых веществах частицы, из которых они состоят, находятся плотно друг к другу и в определённом порядке, как солдаты в строю. Такое упорядоченное строение частиц имеют кристаллы. Силы притяжения частиц в кристаллах велики, оторвать эти частицы очень непросто.
Жидкие вещества – это нечто промежуточное между газами и твёрдыми веществами.
Жидкости имеют объём, как и твёрдые вещества, расстояние между молекулами небольшое, но силы притяжения между частицами не так велики, как в кристаллах.
Есть ещё вещества, которые настолько вязкие, что долго сохраняют свою форму, как твёрдые вещества, однако расположение частиц в них неупорядоченное, как в жидкостях. Такие вещества называются аморфными. Аморфными веществами являются янтарь, воск, стекло, смолы, многие пластмассы.

Но как можно отличить кристаллическое вещество от аморфного? Если, например, нагреть стекло, то оно размягчится, потом становится текучим, пока не превратится в типичную жидкость. То есть резкой границы между аморфными веществами и жидкостями нет.
У каждого же твёрдого вещества есть определённая температура плавления, при которой оно переходит из твёрдого состояния в жидкое.
Домашнее задание:
Сделать краткий конспект урока.
Используя дополнительные источники информации заполните таблицу.
Агрегатное состояние | Цвет | Растворимость в воде | Температура кипения и плавления | Тепло- и электро-проводность | |
поваренная соль | |||||
сахар | |||||
алюминий | |||||
цинк | |||||
железо | |||||
медь | |||||
кислород | |||||
вода | |||||
сера |
01.09.2022
Добрый день! Мы начинаем изучать предмет Химия.
Для работы нам понадобятся 1 рабочая тетрадь (38 листов), 1 тетрадь для практических работ (12 листов), 1 тетрадь для контрольных работ (12 листов).
Электронный учебник для 8 класса вы найдете по ссылке: https://cdnpdf.com/pdf-13229-himiya-neorganicheskaya-himiya-8-klass-rudzitis-ge-feldman-fg
Электронный задачник: https://xp4stm90bvzr.frontroute.org/s11/1/1/3/7/8/0-11378.pdf
Тема: Предмет химии. Роль химии в жизни человека. Химия в системе наук.
Просмотрите видео по ссылке: https://www.youtube.com/watch?v=vhsSF_7GK2c
Мы начинаем знакомство с новым предметом, который называется «химия».
В тетрадях число, классная работа, тема урока.
В младших классах вы изучали природоведение, затем приступили к изучению биологии и физики, познакомились с понятиями «физическое тело» и «вещество».
В: Как вы для себя понимаете, что такое физическое тело?
Ответы учащихся.
Запишем: Физическое тело – это материальный объект, имеющий постоянные массу и форму, и отделенный от других тел.
В: Приведите примеры? (Книга, стол, доска).
Чтобы выяснить, чем отличаются понятия «физическое тело» и «вещество», вспомните из курса природоведения и биологии сведения о составе физических тел, например, гранита и зерна.
Кусок гранита, зерно – это физические тела, но они неоднородны.
На уроках биологии вы изучали, что в состав зерна входят крахмал, белок, растительные жиры; а на уроках природоведения, - что гранит состоит из кварца, слюды и полевого шпата.
Кварц, слюда, полевой шпат, крахмал, белок, жиры – это вещества.
Одни и те же предметы часто изготавливают из разных веществ: например, кружки бывают стеклянные, пластмассовые, металлические (показываю). И наоборот, из одного и того же вещества изготавливают разные предметы: из стекла – посуда, оконное стекло, линзы в приборах (показываю).
Запишем: Свойства вещества – это признаки, по которым вещества отличаются друг от друга или сходны между собой.
Сравним: стекло и металл. Сходны – твердые, различаются – хрупкое/прочное, прозрачное/непрозрачное.
Запишем следующее утверждение: Физические тела состоят из веществ.
Нам необходимо познакомиться с некоторыми свойствами веществ.
Запишем: Важнейшие физические свойства вещества.
1. Агрегатное состояние.
- твердое;
- жидкое;
- газообразное.
2. Цвет, запах.
3. Плотность.
4. Теплопроводность.
5. Электрическая проводимость.
6. Температура плавления и кипения
Итак, мы с вами пришли к выводу – к определению химии, как науки.
Запишем: Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Домашнее задание:
Выучить § 1.
Выполнить письменно задания № 3-5 стр. 6-7.
Внимание!
Задания высылать на почту: shoshin981@gmail.com
Указывать дату урока. Фамилию Имя, класс, название предмета (Химия).
Удачи!
Комментариев нет:
Отправить комментарий