Внимание!
Доброе утро! С 07.11.2022 г.
Все уроки будут выкладываться в группе Вконтакте.
Там же будут выкладываться ссылки на Телемост по расписанию. Присутствие на уроке строго обязательно!
Ссылка: https://vk.com/club216978964
24.10.2022
Тема: Получение алкенов
В промышленности
В природе алкены встречаются в меньшей степени, чем предельные углеводороды, вследствие своей высокой реакционной способности. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, поэтому их получают с использованием различных реакций.
1.Крекинг алканов
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400о-700оС).
2.Дигидрирование алканов (отщепление молекул водорода)
Реакция проводится при температуре 4000С, катализатором является оксид хрома (III) или Ni.
3.Гидрирование алкинов (присоединение молекул водорода)
В лаборатории
Алкены получают по реакциям отщепления (элиминирования) двух атомов или групп атомов от соседних атомов углерода с образованием между ними π-связи.
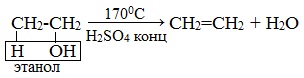
1. Дегидратация спиртов (отщепление молекул воды)
Этилен получают при нагревании этилового спирта в присутствии концентрированной серной кислоты, как сильного водоотнимающего вещества при нагревании и недостатке спирта:
При внутримолекулярной дегидратация вторичных и третичных спиртов атом водорода отрывается от менее гидрогенизированного соседнего атома углерода (правило А.М.Зайцева).
Видеоопыт «Получение этилена из этилового спирта»
Видеоопыт «Получение этилена и опыты с ним»
2. Дегидрогалогенирование моногалогеналканов действием спиртового раствора щелочи (происходит по правилу Зайцева)
3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов (Mg, Zn)
Домашнее задание: Прочитать § 11.
Выполнить задания № 7, 8 стр. 54.
17.10.2022
Тема: Алкены. Свойства алкенов.
Цель урока: Изучить химические свойства алкенов на основе особенности строения их молекул. Научить записывать уравнения химических реакций, характеризующих химические свойства алкенов.
Гомологический ряд, номенклатура, изомерия
Алкены — это нециклические углеводороды, в молекулах которых есть одна двойная связь.
Алкены относятся к группе непредельных углеводородов. Непредельными углеводородами являются вещества, в состав молекул которых входит меньшее, чем у алканов, число атомов водорода. Поэтому они способны к реакциям присоединения, т. е. являются ненасыщенными.
Вопрос. Может ли существовать алкен, в состав которого входит один атом углерода?
Поскольку двойная связь связывает два атома углерода, минимальное число атомов углерода в молекуле алкена равно двум. Сравним состав алкана и алкена:
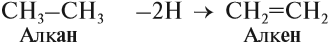
Общая формула:
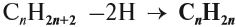
Таким образом, алкены образует гомологический ряд, общая формула которого
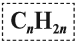
Вопрос. Почему в названиях алкенов появился суффикс ЕН? (См. урок 17.7.)
Упражнение 19.1. Составьте графические формулы алкенов для n = 4.
Решение. Состав этого углеводорода С4Н8. Он содержит двойную связь. Для него возможны три углеродные цепочки:
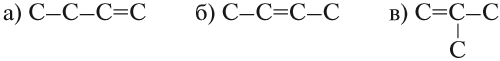
Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры.
Вывод. Начиная с бутена (n = 4) у алкенов возможна структурная изомерия, которая связана
- со строением углеродной цепи: (а) и (в);
- с положением двойной связи: (а) и (б).
Кроме того, для некоторых алкенов возможна пространственная (цис-транс-) изомерия. Цис-транс-изомеры отличаются друг от друга расположением одинаковых атомов или групп атомов по отношению к двойной связи. Такие изомеры есть у алкенов, в молекулах которых около двойной связи имеются разные радикалы (атомы, группы). Например, у бутена-2 [это формула (б)] второй и третий атомы углерода связаны с двумя разными группами: –СН3 и –Н:

Задание 19.1. Назовите оставшиеся два изомера бутена (а) и (в).
Таким образом, в названиях алкенов присутствие двойной связи обозначают при помощи суффикса ЕН, а положение двойной связи показывают цифрой, которую записывают после суффикса. Эта цифра указывает на меньший номер атома углерода при двойной связи. Нумерация атомов углерода основной, главной цепи начинается с того конца, к которому ближе двойная связь.
Упражнение 19.2. Назвать углеводород:
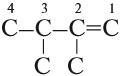
Решение. Основная цепь содержит 4 атома углерода, причём двойная связь соединяет атомы углерода № 1 и № 2 (нумеруем справа налево, так как к правому концу ближе двойная связь). Получаем: бутен-1.
У второго и третьего атомов углерода имеются радикалы «метил», всего их два (обозначение — ДИ); получаем: 2,3-диметилбутен-1.
Задание 19.2. Составьте графические формулы изомеров алкена с n = 5; назовите полученные соединения.
Кроме рассмотренных выше названий по международной номенклатуре IUPAC, на практике применяются и так называемые тривиальные названия. Например, этен обычно называют этилен, пропен — пропилен и т. д. Поэтому алкены называются «этиленовые углеводороды», тем более что по свойствам похожи на этилен.
Строение молекул
Молекулы алкенов отличаются по строению от молекул алканов тем, что они содержат двойную связь. Рассмотрим строение этой связи. Эта связь ковалентная, но неоднородная. Одна из двух связей имеет ту же природу, что и связь в молекулах алканов, т. е. это прочная σ-связь. Другая связь двойной связи образуется иначе, она менее прочная и обозначается буквой π(пи). Это π-связь. Таким образом, в молекуле этена (этилена) имеется:
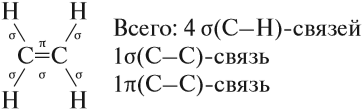
Вопрос. Какая связь будет легче разрушаться в химических реакциях: σ- или π-связь?
В результате алкены (и любые другие углеводороды), имеющие π-связь, легко, иногда даже при обычных условиях, вступают в химические реакции, причём эти реакции происходят за счёт разрыва π-связи.
Свойства алкенов
Физические свойства
По физическим свойствам алкены почти не отличаются от алканов: низшие алкены (этилен, пропилен и др.) — газы, а с увеличением молекулярной массы увеличиваются и температуры кипения и температуры плавления. Это неполярные вещества, поэтому они практически нерастворимы в воде, но хорошо растворяются в бензине, маслах.
Химические свойства
Наиболее характерной реакцией для алкенов является реакция присоединения. В ходе этой реакции разрывается непрочная π-связь, в результате у обоих атомов углерода, которые соединялись этой связью, появляются «свободные» валентности, за счёт чего и происходит присоединение:
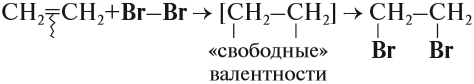
Эта реакция бромирования этилена (и других алкенов) происходит при нормальных условиях под действием раствора брома в воде (бромной воды). В результате цвет бромной воды изменяется: был жёлтым, становится бесцветным.
Поэтому реакция обесцвечивания бромной воды является качественной* на двойную связь.
* Качественной называется химическая реакция, при помощи которой можно обнаружить вещество в смеси или в растворе. В результате качественной реакции изменяется цвет, выделяется газ, осадок.
Аналогично происходят и другие реакции присоединения: с Н2 (гидрирование), с Н2O (гидратация), с НСl и т. д. При этом в результате реакции присоединения двойная связь всегда разрушается (разрывается π-связь). Изменяется характер химической связи: вместо двойной связи появляется простая связь. Образуется одно вещество:
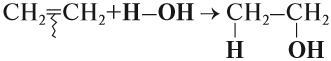
Во всех случаях, которые рассматривались ранее, в результате реакции присоединения могло получиться только одно вещество (один изомер). Но так бывает не всегда. Попробуем составить уравнение реакции пропена с хлороводородом:
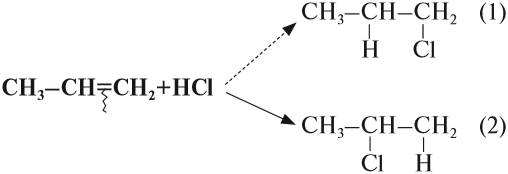
Какой изомер получится: (1)? или (2)? или оба? Эта задача решается при помощи правила Марковникова (1869 год)*.
* Марковников Владимир Васильевич (25.12.1837–11.02.1904) — русский химик-органик. Ввёл понятие о взаимном влиянии атомов как главном содержании теории химического строения.
Соединения типа Н-Х присоединяются по месту разрыва двойной связи так, что при этом атом водорода (вещества Н-Х) присоединяется к атому углерода, у которого было больше атомов водорода (наиболее гидрогенизированный атом углерода).
Вопрос. Какой изомер получился при гидрировании бутена-2: (1) или (2)?
При составлении уравнений таких реакций, конечно, нужно «считать» атомы водорода только у тех атомов углерода, которые связаны двойной связью:
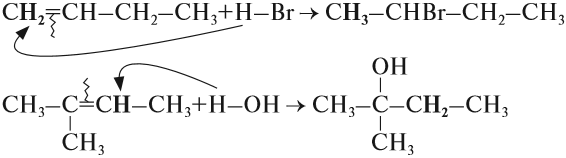
В отличие от алканов, алкены вступают в реакции окисления* и при обычных условиях. Так, если этилен пропустить через розовый раствор перманганата калия (КМnО4), то раствор станет бесцветным:
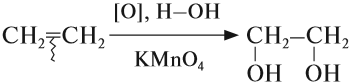
* Реакции мягкого окисления, в которых не разрушается углеродная цепь атомов, обозначается [O], а формула вещества-окислителя записывается под стрелочкой.
Вопрос. Является ли эта реакция качественной на двойную связь?
Таким образом, для обнаружения двойной связи в углеводороде, можно воспользоваться любой из качественных реакций:
- обесцвечивание бромной воды;
- обесцвечивание раствора перманганата калия.
Алкены горят, но, в отличие от газообразных алканов, пламя которых бесцветно, газообразные алкены горят светящимся (ярким) пламенем.
Алкены легко вступают в реакцию полимеризации. Это процесс, при котором из большого числа молекул (мономеров) образуется ОДНА большая молекула (полимер):
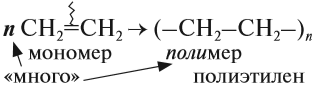
Вопрос. Является ли полиэтилен химически активным веществом? Почему?
Полиэтилен, в отличие от этилена, уже не содержит двойной связи, поэтому он химически инертен, т. е. практически не вступает в химические реакции. Поэтому из него делают плёнки, различные изделия, которые широко применяются в быту (полиэтиленовые пакеты*) и в химической промышленности (трубы, ёмкости и др.).
* Полиэтиленовые пакеты часто неправильно называют «целлофановыми», хотя целлофан — совсем другой материал.
Задание 1. Составьте уравнения реакций:
- пропен + водород;
- бутен-2 + вода.
Задание 2. Составьте уравнение реакции горения этилена.
Задание 3. Составьте уравнения реакций:
- пропен + бром;
- бутен-1 + хлороводород;
- 2-метилпропен + вода.
12.10.2022
10 класс
Дорогие ребята!
Поздравляем
вас с участием в обучающей открытой ученической олимпиаде по химии. Отвечая на
вопросы и выполняя задания, не спешите, так как ответы не всегда очевидны и
требуют применения не только химических знаний, но и общей эрудиции, логики и
творческого подхода. Желаем вам удачи!
Внимание! Задания выполняем на двойных листиках. Фотографии высылаем до 16-00 на мою почту.
1.Какие газы можно получить, имея в своем распоряжении
следующие вещества:
хлорид натрия, серную кислоту,
нитрат аммония, воду, нитрит аммония, соляную кислоту, перманганат калия,
гидроксид натрия, карбид алюминия, карбид кальция и сульфит натрия?
Напишите все уравнения возможных
реакций, укажите условия их протекания.
За каждое уравнение реакции 1 балл
Всего -10 баллов
2. В органических соединениях атом углерода называют первичным,
вторичным, третичным или четвертичным в зависимости от того, с каким числом
соседних углеродных атомов (с одним, двумя, тремя или четырьмя) он связан. В
таблице приведены сведения о некоторых предельных углеводородах.
|
Алкан |
Число первичных
атомов |
Число вторичных атомов |
Число третичных атомов |
Число четвертичных атомов |
|
А |
2 |
0 |
0 |
0 |
|
B |
2 |
1 |
0 |
0 |
|
C |
2 |
2 |
0 |
0 |
|
D |
3 |
0 |
1 |
0 |
|
E |
2 |
3 |
0 |
0 |
|
F |
3 |
1 |
1 |
0 |
|
G |
4 |
0 |
0 |
1 |
|
H |
5 |
0 |
1 |
1 |
Напишите структурные формулы углеводородов А–Н и приведите их названия.
За
каждое правильно составленную структурную формулу – по 1 баллу.
За
каждое правильно составленное название соединения – по 1 баллу.
Всего – 16 баллов.
3.В 1928 году американскому химику
корпорации «Дженерал Моторс»
(«GeneralMotorsResearch»)
Томасу Мидглей младшему удалось синтезировать и выделить в своей лаборатории химическое
соединение, состоявшее на 23,53% из углерода,1,96% водорода и 74,51% фтора.
Полученный газ был в 3,52 раза тяжелее воздуха и не горел. Выведите формулу
соединения, напишите структурные формулы органических веществ, соответствующих
полученной молекулярной формуле, дайте им названия по номенклатуре ИЮПАК. Где
применяются в наше время подобные соединения?
Всего - 10 баллов (поэтапное оценивание по баллам в
решении)
4.
Для трех химических элементов А, В и
С известно, что они принимают участие в следующих превращениях:
1)
С2 + 3В2![]() 2СВ3
2СВ3
2)
4СВ3 + 5А2![]() 4СА
+ 6В2А
4СА
+ 6В2А
3)
4СВ3 + 3А2 =
2С2 + 6В2А
4)
С2 + А2 = 2 СА
5)
4СА2 + 2В2А +
А2 = 4ВСА3
О каких элементах идет речь в
задании? Запишите уравнения реакций.
За каждое уравнение реакции 1 балл
Всего – 5 баллов.
5.
При растворении 11,5 г смеси
алюминия, магния и меди в соляной кислоте выделилось 5,6 л (н.у.) газа.
Нерастворившийся остаток переведен в раствор концентрированной азотной
кислотой. При этом выделилось 4,48 л (н.у.) газа. Определите массовые доли (в%)
компонентов исходной смеси.
Всего - 10 баллов(поэтапное оценивание по баллам в решении)
6. В четырёх пронумерованных пробирках находятся
растворы хлорида бария, карбоната натрия, сульфата калия и хлороводородная
кислота. В вашем распоряжении имеется необходимое число пустых пробирок. Не
пользуясь никакими другими реактивами, определите содержимое каждой из
пробирок. Запишите уравнения реакций ионного обмена для каждого случая.
За каждую
реакцию ионного обмена 2 балла, за объяснения к каждой 2 балла
Всего -12 баллов
7. Напишите
структурные формулы всех алканов с пятью атомами углерода в главной цепи,
плотность паров которых по водороду равна 50. Назовите их по систематической
номенклатуре.
Всего - 17 баллов
8.
Газ, образующийся при
полном сгорании 0,1 моль предельного углеводорода, пропустили через избыток
известковой воды, при этом выпало 60 г осадка. Определите молекулярную формулу
и строение предельного углеводорода, если известно, что он содержит один четвертичный
атом углерода.
10.10.2022
Тема: Свойства Алканов.
Цель урока: изучение важнейших химических свойств и применения алканов.
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
![]() Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
| Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом. С третичный–Н > С вторичный–Н > С первичный–Н |
| Например, при бромировании 2-метилпропана преимущественно образуется 2-бром-2-метилпропан: |
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
| Например. При нитровании пропана образуется преимущественно 2-нитропропан: |
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен: |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана.
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:![]()
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
| Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды. |
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
| Например, н-бутан под действием катализатора хлорида алюминия и при нагревании превращается в изобутан: Выполните задания: ЧАСТЬ А При выполнении заданий этой части для каждого задания (А1 – А10) запишите цифру, которая соответствует номеру выбранного вами ответа. Задание A1 Общая формула алканов 1) СnH2n–6 2) CnH2n–2 3) CnH2n 4) CnH2n+2 Задание A2 Название углеводорода, формула которого C5H12 1) этан 2) пентан 3) бутан 4) пропан Задание A3 Изомером октана является: 1) 2,3-диметилгептан; 2) 2,3-диметилбутан; 3) 2,3-диметилпентан; 4) 2,3-диметилгексан. Задание A4 Молекулярная формула бутана 1) СH4 2) C3H6 3) C4H10 4) C4H8 Задание A5 Гомологом 2,4-диметилоктана является: 1) 2,5-диметилгептан; 2) 3,3-диметилбутан; 3) 2,3-диметилпентан; 4) 2,4-диметилгексан. Задание A6 Процесс разложения углеводородов нефти на более летучие вещества называется 1) крекинг 2) дегидрирование 3) гидрирование 4) дегидратация Задание A7 Пропан реагируют 1) с водой 2) с раствором KMnO4 3) с водородом 4) с хлором Задание A8 Сумма коэффициентов в уравнении реакции полного сгорания этана равна 1) 10 2) 9 3) 19 4) 16 Задание A9 Известно термохимическое уравнение горения метана CH4 + 2O2 → CO2 +2H2O + 896 кДж. Какое количество метана расходуется при выделении 89,6 кДж теплоты? 1) 0,1 моль 2) 0,2 моль 3) 0,25 моль 4) 0,5 моль Задание A10 Реакция горения алкана 1) 2C3H6 + 9О2 6 CО2 +6 H2О 2) 2С2H2 +5О2 4CО2 + 2H2О 3) C3H8+ 5О2 3CО2 +4 H2О 4) С2H4 +3О2 2CО2 + 2H2О
При ответе на задания этой части запишите полный ответ Задание В1 Составьте структурную формулу органического вещества 2,2,4 – триметилгексана. Задание В2 При полном сгорании циклического углеводорода образовался оксид углерода (IV) массой 3,52 г и вода массой 1,44 г. Относительная плотность этого углеводорода по воздуху равна 1,448. Найдите молекулярную формулу углеводорода. |
03.10.2022
Тема: Алканы.
Цель урока: формирование представления о предельных углеводородах как классе органических соединений.
- Алканы (парафины) - это насыщенные (то есть без двойных и тройных связей) ациклические (то есть без циклов) углеводороды (соединения, состоящие только из атомов углерода и водорода).
В качестве примера приведем первые шесть линейных алканов, они образуют гомологический ряд:
| CH4 | метан | 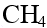 | 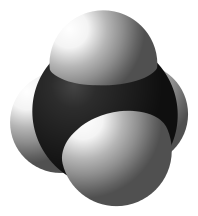 |
| C2H6 | этан | 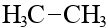 | 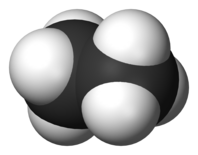 |
| C3H8 | пропан | 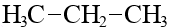 | 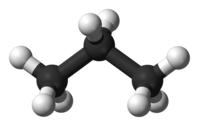 |
| C4H10 | бутан | 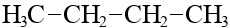 | 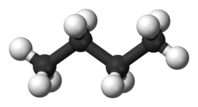 |
| C5H12 | пентан | 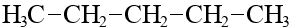 | 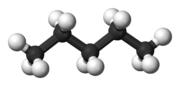 |
| C6H14 | гексан | 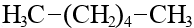 | 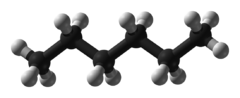 |
Общая формула алканов:
CnH2n+2
Общая формула показывает, что на каждый углерод (n) приходится по два водорода (2n), плюс еще два дополнительных, это хорошо видно в структуре алкана:
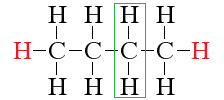
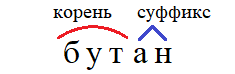
• бут – цепь из четырех атомов,
• ан – отсутствие кратных связей,
принадлежность к классу алканов.
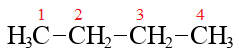
Систематическое название линейного алкана строится из:
– корня, который подсказывает, сколько атомов углерода в цепи (памятка: список корней),
– суффикса «ан», что указывает на принадлженость к классу алканы (в то время как у алкенов суффикс будет, ожидаемо, «ен» и т. д.)
Например, см. анализ слова «бутан» справа.
Очень рекомендую выучить наизусть все десять корней, потому что, зная их, вы легко сможете строить названия миллионов органических веществ, просто добавляя суффикс «ан», или суффикс другого класса.
Разветвленные алканы
Ответвления от основной цепи алкана называются радикалы (иногда говорят «алкилы», «заместители»), названия радикалов строятся также, как названия алканов, но суффикс у них «ил»:
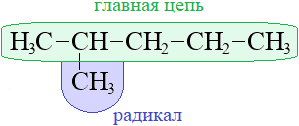
| CH3 | метил | 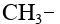 |
| C2H5 | этил |  |
| C3H7 | пропил | 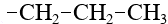 |
Название разветвленного алкана строится так:
– сначала перечисляются все радикалы с указанием их локанта,
– потом идет название главной цепи:
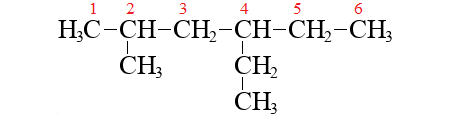
Если имеется несколько одинаковых радикалов, перед их названием перечисляются все их локанты, и указывается кратная приставка:
2 – «ди», 3 – «три», 4 – «тетра», и т. д.
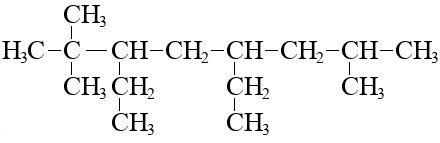
Нумерация в главной цепи начинается с того конца, к которому ближе радикал, если радикал ближе к правому концу, нумеровать следует справа:
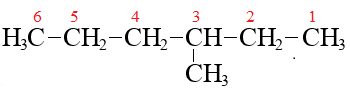
(и вообще, по-хорошему, такую молекулу лучше рисовать, «перевернув», чтобы метил был ближе к левому концу)
Если заместителей несколько, выбираем заместитель, ближайший к какому-нибудь концу, нумерация должна быть такова, чтобы этот заместитель получил наименьший локант.
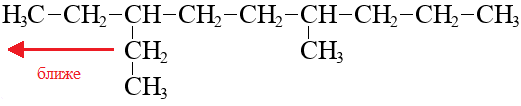
Сами заместители перечисляем в алфавитном порядке.
Если существует лишь один вариант молекулы с данным радикалом, этот радикал нумеровать бессмысленно:
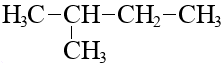
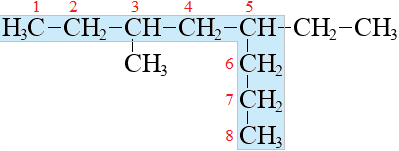
Выбор родоначальной цепи
У разветвленного алкана родоначальную цепь можно выбрать разными способами, верным является тот способ, при котором главная цепь окажется самой длинной:
Для алканов характерна структурная изомерия, например, у бутана есть один изомер: метилпропан (изобутан), оба эти вещества отвечают брутто-формуле C4H10:

У гексана существует 4 изомера, отвечающих формуле C6H14. (как искать изомеры на сайте).
Чем больше молекула, тем больше у нее возможных изомеров, например, формуле C20 H42 отвечает аж 366 тысяч изомеров!
Ссылка на видео:
https://yandex.fr/video/preview/2784585699530581030
Домашнее задание:
Прочитать § 7, 8.
Выучить и записать в тетради названия первых десяти алканов и радикалов (табл. 1, стр. 31).
Выполнить задания № 6, стр. 30.
№ 3, 4, стр. 33.
19.09.2022
Существует несколько критериев классификации органических соединений.
Классификация по составу. Согласно этой классификации все органические вещества делятся на: углеводороды, которые состоят только из атомов углерода и водорода, кислородсодержащие соединения, которые состоят не только из атомов углерода и водорода, но и ещё и из кислорода. Азотсодержащие соединения содержат кроме углерода и водорода ещё и атом азота.
Однако эта классификация является не точной, потому что в одну группу могут попадать вещества, имеющие совершенно разные свойства. Например, диметиловый эфир, как и этанол, является кислородсодержащим соединением, но диметиловый эфир является простым эфиром и представляет собой газ, а этанол относится к классу спиртов и представляет собой жидкость.
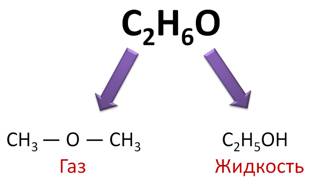
Поэтому более совершенной классификацией является классификация по строению. В этой классификации можно ещё выделить несколько признаков классификации: по типу скелета молекулы, по наличию (или отсутствию) в молекуле кратных связей и бензольных колец, по наличию (или отсутствию) функциональных групп.
В состав молекул, кроме атомов углерода и водорода, могут входить атомы O, S, N. Поэтому по наличию или отсутствию гетероатомов различают скелет молекулы углеродный и гетероатомный. Так в молекуле этанола скелет считается углеродным, потому что атом кислорода не включён в скелет молекулы, а в молекуле диметилового эфира атом кислорода включён в скелет молекулы, поэтому его скелет считается гетероатомным.

Скелет молекулы может быть неразветвлённым, когда все атомы углерода соеденены последовательно, как в молекуле бутана, а также разветвлённым, как в молекуле изобутана.

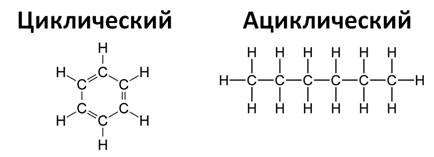
Цепь из атомов углерода может быть замкнутой, тогда эту систему называют циклом, или цепь может быть незамкнутой, тогда такую молекулу называют ациклической (алифатической).
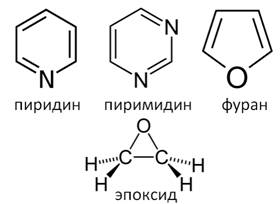
Циклические соединения бывают карбоциклическими и гетероциклическими. Карбоциклические соединения делят на алициклические (например циклогексан) и ароматические (бензол). Гетероциклические соединения в цикле вместо атомов углерода содержат атом или несколько атомов других элементов. К таким соединениям относят пиридин, пиримидин, фуран.
В углеродном скелете различают первичный, вторичный, третичный и четвертичный атомы углерода. Первичным называют атом углерода, который связан только с одним другим атомом углерода, вторичный атом углерода всегда связан с двумя другими атомами углерода, третичный – с тремя другими атомами углерода, а четвертичный – с четырьмя другими атомами углерода.
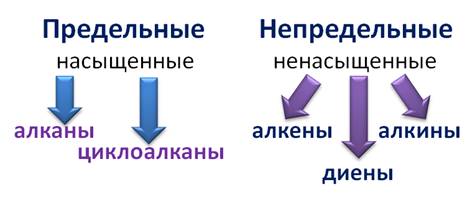
Ещё одним признаком классификации является наличие (или отсутствие) в молекуле кратных связей и бензольных колец. Алифатические соединения не содержат бензольных колец, их иногда ещё называют соединениями жирного ряда. Но от того содержат они кратные связи или нет их подразделяют на предельные, или насыщенные, и на непредельные, или ненасыщенные. Предельные, или насыщенные соединения содержат только простые (одинарные) связи, а непредельные, или ненасыщенные содержат кроме простых ещё и кратные связи – двойные или тройные. Ароматические соединения содержат бензольное кольцо. К насыщенным углеводородам относят алканы и циклоалканы. К углеводородам, имеющим кратные связи, относят алкены, алкины и диены.
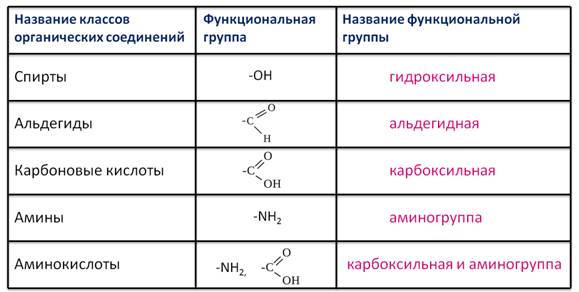
Есть ещё и классификация соединений по наличию (или отсутствию) функциональных групп. Есть вещества, которые не содержат функциональных групп, а есть вещества, которые содержат одну или несколько функциональных групп. Если в составе молекулы одна функциональная группа, то это соединение относится к монофункциональным соединениям. Например, этанол – это монофункциональное соединение, потому что содержит только одну группу ОН. Полифункциональные соединения содержат несколько одинаковых групп, например глицерин – трёхатомный спирт, является полифункциональным соединением, потому что содержит три одинаковые группы – ОН. Гетерофукциональные соединения содержат разные функциональные группы. Например, аминоуксусная кислота содержит две различные функциональные группы – аминогруппу и карбоксильную группу.
Рассмотрим соединения, имеющие функциональные группы. Спирты содержат гидроксильную группу, как и фенолы, альдегиды – альдегидную, карбоновые кислоты — карбоксильную, амины содержат аминогруппу, а аминокислоты – амино- и карбоксильную группы.
Посмотрите видео по ссылке:
https://yandex.fr/video/preview/7616738891530300341
Внимательно прочитайте § 6. Сделайте краткий конспект урока.
Выполнить задания № 3-5 стр. 21.
12.09.2022
Теория строения органических соединений. Типы связей в молекулах органических веществ
Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Теория химического строения органических соединений А. М. Бутлерова
Подобно тому, как для неорганической химии основой развития являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, для органической химии основополагающей стала теория строения органических соединений А. М. Бутлерова.
Основным постулатом теории Бутлерова является положение о химическом строении вещества, под которым понимается порядок, последовательность взаимного соединения атомов в молекулы, т.е. химическая связь.
Под химическим строением понимают порядок соединения атомов химических элементов в молекуле согласно их валентности.
Этот порядок может быть отображен при помощи структурных формул, в которых валентности атомов обозначаются черточками: одна черточка соответствует единице валентности атома химического элемента. Например, для органического вещества метана, имеющего молекулярную формулу
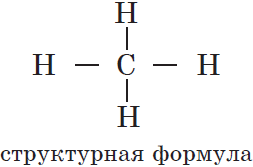
Основные положения теории А. М. Бутлерова
- Атомы в молекулах органических веществ связаны друг с другом согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи.
- Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением вещества.
- Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
Теория строения органических соединений является динамичным и развивающимся учением. По мере развития знаний о природе химической связи, о влиянии электронного строения молекул органических веществ стали пользоваться, кроме эмпирических и структурных, электронными формулами. В таких формулах указывают направление смещения электронных пар в молекуле.
Квантовая химия и химия строения органических соединений подтвердили учение о пространственном направлении химических связей (цис- и трансизомерия), изучили энергетические характеристики взаимных переходов у изомеров, позволили судить о взаимном влиянии атомов в молекулах различных веществ, создали предпосылки для прогнозирования видов изомерии и направления и механизма протекания химических реакций.
Органические вещества имеют ряд особенностей:
- В состав всех органических веществ входят углерод и водород, поэтому при горении они образуют углекислый газ и воду.
- Органические вещества построены сложно и могут иметь огромную молекулярную массу (белки, жиры, углеводы).
- Органические вещества можно расположить в ряды сходных по составу, строению и свойствам гомологов.
- Для органических веществ характерной является изомерия.
Домашнее задание:
05.09.2022
Электронный учебник: https://cloud.mail.ru/public/81Dg/rTiwiDeXq
Электронный задачник: https://obuchalka.org/201012167104/gotovie-domashnie-zadaniya-po-himii-11-klass-k-uchebniku-himiya-11-klass-rudzitis-g-e-feldman-f-g.html
Завести 1 рабочую тетрадь (38 листов), 1 тетрадь для практических работ (12 листов), 1 тетрадь для контрольных работ
Тема: Предмет органической химии.
Органические вещества
С глубокой древности человек использовал в своих целях вещества живой и неживой природы. Из осколков камней наши предки изготавливали наконечники стрел, из руд выплавляли металлы, глину и известняк использовали для строительства жилищ, из мрамора высекали скульптуры. Вещества природного происхождения служили источником пищи, применялись для изготовления одежды, приготовления лекарств, ядов, красителей.
Первые попытки классификации веществ были предприняты ещё в IX—X вв. Арабский алхимик Абу Бакр ар-Рази (865—925) впервые разделил вещества на представителей «минерального, растительного и животного царств». Такое разделение основывалось на том, что «растительные и животные» вещества обладают похожими свойствами: легко разрушаются при нагревании, горят, имеют невысокие температуры кипения и плавления, растворяются в спиртах и маслах. Эта классификация просуществовала почти тысячу лет!
В начале XIX в. число веществ, которые были выделены из объектов живой природы, стало стремительно расти. По предложению выдающегося шведского химика Йёнса Якоба Берцелиуса вещества живой природы стали называть органическими в противоположность минеральным, т. е. неорганическим, веществам.
Были замечены и другие общие особенности органических соединений. При горении все они в основном образуют углекислый газ, сажу, воду и некоторые другие соединения, а следовательно, обязательно содержат в своём составе углерод.
| Органическими веществами называют соединения углерода, за исключением оксидов углерода, угольной кислоты и её солей, карбидов и некоторых других. |
На ранних этапах развития химии учёные считали, что органические вещества могут образовываться только в живых организмах под действием некой «жизненной силы» (по-латыни vis vitalis). Учение о химическом родстве всех живых организмов получило название витализм. Сторонники витализма полагали, что жизненная сила представляет собой неотъемлемый атрибут живых существ и, следовательно, получить органические вещества вне организма, в пробирке или реакторе, невозможно.
Однако ряд открытий, сделанных в середине XIX в., показал, что сторонники витализма глубоко заблуждались.
В 1828 г. немецкий химик Фридрих Вёлер впервые получил органическое вещество — мочевину из неорганической соли (цианата аммония). В 1854 г. французский учёный Марселей Бертло синтезировал аналоги природных жиров, затем в 1861 г. русский химик Александр Михайлович Бутлеров — аналог природного сахара. В конечном счёте под давлением экспериментальных фактов витализм потерпел крах.
Предмет органической химии
Постепенно изучение состава и свойств органических веществ выделилось в самостоятельный раздел химической науки — органическую химию.
Было обнаружено, что большое число органических веществ построено из атомов всего двух химических элементов — углерода и водорода. Такие соединения называют углеводородами. Состав углеводородов выражают общей формулой CхHу, где между индексами х и у существует строгое математическое соотношение.
Углеводороды занимают особое место в органической химии, поскольку соединения всех остальных классов органических веществ можно рассматривать как их производные. Например, если в молекуле метана СН4 один атом водорода заместить карбоксильной группой —СООН, то получится молекула известной вам уксусной кислоты СН3СООН. Замена одного атома водорода в этане C2H6 на гидроксильную группу – ОН даст в результате молекулу этилового спирта С2Н5ОН. Таким образом, и карбоновые кислоты, и спирты (важнейшие классы органических соединений) можно считать производными углеводородов.
Немецкий химик-органик Карл Шорлеммер более ста лет назад сформулировал классическое определение органической химии, не потерявшее своей актуальности до сих пор.
| Органическая химия представляет собой химию углеводородов и их производных, т. е. продуктов замещения атомов водорода в молекулах углеводородов на другие атомы или группы атомов. |
Природные, искусственные и синтетические органические вещества
Поняв, как построены органические соединения, учёные научились не только получать их в лаборатории, но и химически модифицировать, т. е. изменять их строение. Мало того, химики смогли синтезировать соединения углерода, никогда не существовавшие в природе. Таким образом, по происхождению органические вещества можно разделить на три группы: природные, искусственные и синтетические.
Природные органические вещества — это продукты жизнедеятельности любых живых организмов. Название веществ этой группы говорит о том, что в окружающей среде такие соединения существуют независимо от человека, их можно выделить из природных объектов, будь то полезные ископаемые (нефть, газ, каменный уголь, горючие сланцы), растения или животные.
Искусственные органические вещества — это продукты химической модификации природных органических соединений, в результате которой происходит изменение состава и строения исходного вещества с целью придания ему требуемых свойств. Например, в результате химической обработки целлюлозы (основной составной части древесины) получают не существующие в природе волокна (ацетатное, медно-аммиачное, вискозное) и пластмассу (целлулоид).
Синтетические органические вещества «рождаются» в пробирках учёных или в реакторах промышленных предприятий и никогда не встречаются в природе. Пожалуй, сегодня это самая многочисленная группа органических веществ, куда входят лекарства, средства бытовой химии, синтетические каучуки, ядохимикаты, пластмассы, красители и др.
Многообразие органических веществ
Органических веществ гораздо больше, чем неорганических: на сегодняшний день органических веществ насчитывают более 100 млн, а число неорганических не превышает 500 тысяч. Это во многом определяется особенностями строения органических соединений.
Одна из причин уникальности углерода как родоначальника органических соединений была выяснена ещё в середине XIX в. Великий русский учёный Дмитрий Иванович Менделеев в учебнике «Основы химии» писал: «Углерод встречается в природе как в свободном, так и в соединительном состоянии, в весьма различных формах и видах… Способность атомов углерода соединяться между собой и давать сложные частицы проявляется во всех углеродистых соединениях… Ни в одном из элементов… способности к усложнению не развито в такой степени, как в углероде… Ни одна пара элементов не даёт столь много соединений, как углерод с водородом».
Выдающуюся роль в решении вопроса о строении органических соединений сыграл русский химик А. М. Бутлеров. Об этом пойдёт речь в следующем конспекте.
Основные выводы по теме конспекта:
- Раздел химии, изучающий строение, свойства, превращения, способы получения и области применения органических веществ, называют органической химией.
- Органическая химия представляет собой химию углеводородов и их производных, т. е. продуктов замещения атомов водорода в молекулах углеводородов на другие атомы или группы атомов.
- Различают органические вещества природного, искусственного и синтетического происхождения.
Посмотрите видео по ссылкам:
https://www.youtube.com/watch?v=iDRq9KJAUYE
Внимательно прочитайте § 1. Сделайте краткий конспект урока.
Домашнее задание: Выполнить задания № 1-3 стр. 10.
Внимание!
Задания высылать на почту: shoshin981@gmail.com
Указывать дату урока. Фамилию Имя, класс, название предмета.
Удачи!
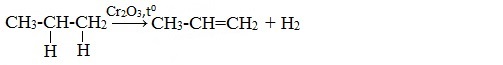
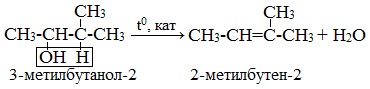
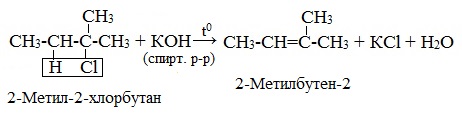
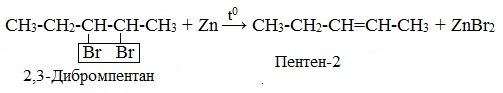












Комментариев нет:
Отправить комментарий